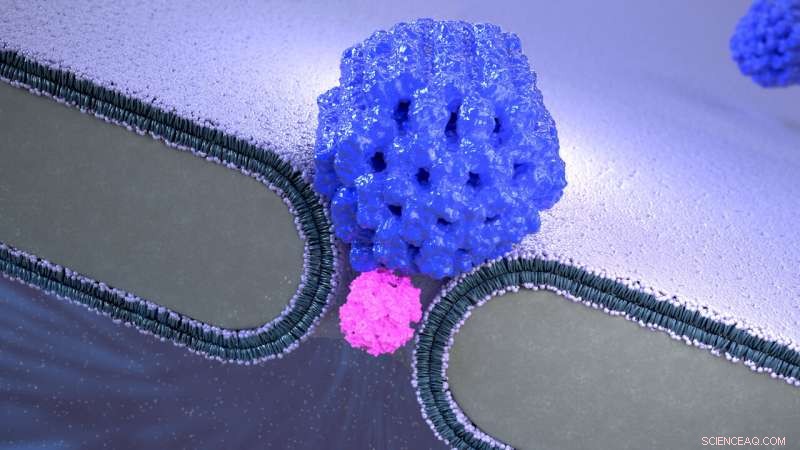
Vue d'artiste du piège électro-osmotique Nanopore (NEOtrap) - une nouvelle méthode d'analyse de molécules individuelles. Une nanobille d'ADN-origami recouvre un nanotrou solide, lui permettant de piéger des molécules de protéines individuelles non modifiées, permettant des analyses sensibles à la conformation d'une heure. Crédit :Cees Dekker Lab / SciXel
Des chercheurs des universités techniques de Delft et de Munich ont inventé un nouveau type de piège moléculaire qui peut maintenir une seule protéine en place pendant des heures pour étudier son comportement naturel, un million de fois plus longtemps qu'auparavant. La nouvelle technique NEOtrap permet aux scientifiques d'utiliser des courants électriques pour étudier la nature vibrante des protéines, qui peut susciter l'innovation en biomédecine, biotechnologie, et plus.
Même si les protéines sont cruciales pour la vie, en vous fournissant une vision et des connexions neuronales pour lire ce texte, par exemple, la façon dont ils changent de forme est encore mal comprise. Tel que publié le lundi 30 août dans Nature Nanotechnologie , une équipe dirigée par Cees Dekker à l'Université de technologie de Delft a développé une nouvelle technique, appelé piège électro-osmotique Nanopore (NEOtrap), d'étudier des molécules de protéines individuelles beaucoup plus longtemps qu'auparavant. Le NEOtrap permet aux chercheurs de mesurer comment des protéines individuelles changent de forme au fil du temps.
Comme un bouchon sur une bouteille
Le NEOtrap combine deux nanotechnologies :les nanopores à l'état solide et l'origami ADN. Les nanopores sont de petits trous que les scientifiques utilisent comme capteurs pour des molécules uniques telles que les protéines. Étant donné que les protéines traversent normalement le petit trou en quelques microsecondes, ils ne peuvent être enregistrés que brièvement. En scellant le nanotrou avec une boule nanométrique construite entièrement à partir d'ADN (!), les chercheurs peuvent verrouiller la protéine en place pendant des heures, un peu comme un bouchon de liège scelle une bouteille de vin. Hendrik Dietz et son groupe de l'Université technique de Munich ont construit cette nano-boule en utilisant une approche appelée « origami d'ADN » - une technique qui imite le pliage d'origami à grande échelle - en utilisant des brins d'ADN à l'échelle nanométrique plutôt que du papier.
Auteur principal de l'article Sonja Schmid, qui a développé le NEOtrap en tant que post-doctorant dans le laboratoire de Dekker, explique :"Cette nano-boule d'ADN-origami agit comme une éponge qui aspire l'eau à travers le nanopore, attirer une seule protéine vers le nanopore et l'y piéger. Cela signifie que nous pouvons étudier cette protéine pendant de très longues périodes. Dans ce travail, nous avons déjà démontré que nous pouvons distinguer différents types de protéines, et même différentes formes fonctionnelles d'une même protéine."
Avancement radical dans le domaine
Cees Dekker ajoute :« Cette nouvelle technique est vraiment un grand pas en avant — un critique anonyme de notre article l'a qualifiée de « l'une des avancées les plus radicales dans le domaine de la détection des nanopores ». le NEOtrap nous permet de piéger une seule protéine native sans avoir besoin de modifier la molécule d'intérêt, contrairement aux techniques précédentes. Cette technique peut, par exemple, aider les chercheurs à découvrir le mécanisme sous-jacent des enzymes et d'autres protéines importantes qui changent de forme pour faciliter les réactions chimiques."
Le NEOtrap permet aux scientifiques du monde entier de mener des expériences entièrement nouvelles, avec le potentiel de révéler des caractéristiques fonctionnelles des protéines jusque-là négligées et donc de susciter l'innovation en biomédecine, biotechnologie, et plus. Schmid (qui a maintenant ouvert son propre laboratoire à Wageningen) et Dekker prévoient de nombreuses études de suivi sur la dynamique des protéines individuelles dans les années à venir.