Le facteur limitant de la radiothérapie anticancéreuse est que des doses suffisamment élevées pour tenter de guérir les tumeurs endommagent également les tissus normaux environnants. Crédit :Shutterstock
Le cancer est la deuxième cause de décès dans le monde. En 2018, il y a eu 18,1 millions de nouveaux cas et 9,5 millions de décès liés au cancer dans le monde. D'ici 2040, le nombre de nouveaux cas de cancer par an devrait atteindre 29,5 millions et le nombre de décès liés au cancer à 16,4 millions.
Environ 50 pour cent de tous les patients atteints de cancer peuvent bénéficier de la radiothérapie dans la gestion de leur maladie. Environ la moitié de ces patients sont diagnostiqués suffisamment tôt pour que leur cancer puisse être guéri. Pour de nombreux cancers dont le sein, prostate, col de l'utérus, tête et cou, cancers du poumon et du cerveau, le traitement curatif comprend la radiothérapie. Cependant, car la radiothérapie détruit aussi bien les cellules saines que les cellules tumorales, les doses sont limitées.
Radiothérapie, aussi appelée radiothérapie, est utilisé seul pour traiter le cancer ou avec d'autres options de traitement telles que la chimiothérapie et la chirurgie. Il peut également être utilisé pour réduire la tumeur avant la chirurgie. En radiothérapie, les cellules tumorales, qui se divisent beaucoup plus rapidement que les autres cellules saines environnantes, sont détruites en endommageant leur ADN.
Les effets secondaires limitent la dose de rayonnement
Le facteur limitant en radiothérapie est que des doses suffisamment élevées pour tenter de guérir les tumeurs non métastatiques à haut risque (localement avancées) endommagent également les tissus normaux environnants. Actuellement, nous sommes à la limite de la dose de radiothérapie qui peut être donnée aux patients. Pour améliorer encore la survie, il existe un besoin de nouvelles méthodes qui améliorent l'efficacité des rayonnements tout en réduisant les effets secondaires.
Une façon d'y parvenir est de rendre les cellules tumorales plus sensibles aux rayonnements, ces cellules sont donc plus facilement endommagées par la radiothérapie. L'utilisation de nanoparticules d'or comme radiosensibilisateurs a donné des résultats prometteurs. Ces nanoparticules d'or peuvent être introduites par voie intraveineuse pour s'accumuler dans la tumeur en exploitant les parois défectueuses des vaisseaux sanguins de la tumeur, qui ont tendance à fuir en raison d'une croissance rapide.
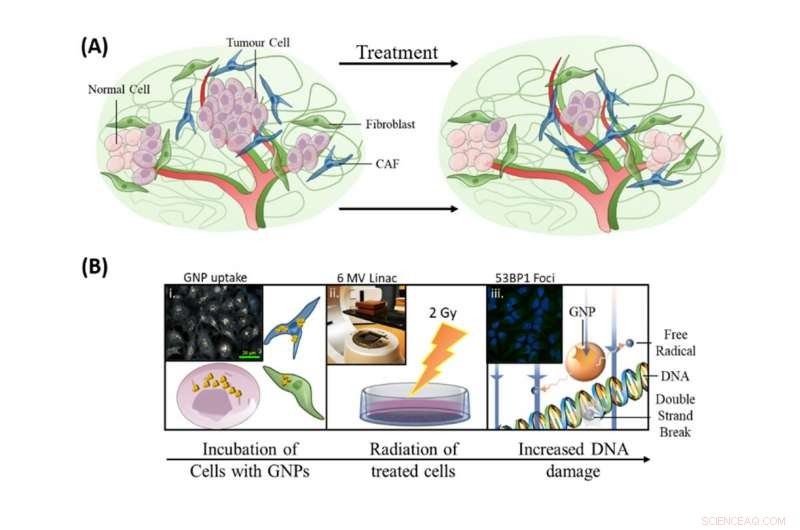
L'incorporation de nanoparticules d'or dans les protocoles actuels de radiothérapie avait trois objectifs :améliorer la destruction des cellules tumorales, cibler les CAF et protéger les fibroblastes. Crédit :Bromma et al. (2020), Rapports Sci, dix, 2181., Auteur fourni
Les nanoparticules d'or interagissent avec les photons X utilisés en radiothérapie qui produisent des électrons, qui interagissent ensuite avec les molécules d'eau pour produire des radicaux libres. Ces radicaux libres peuvent endommager les cellules, diminuant la survie de ces cellules.
Comprendre le système biologique complexe présent dans et autour de la tumeur est essentiel pour optimiser l'utilisation des PNB radiosensibilisants, comme indiqué par un consortium de laboratoires, y compris notre propre laboratoire de nanosciences et de développement technologique à l'Université de Victoria.
Cibler les interactions à l'intérieur de la tumeur
Dans ce travail, nous discutons de l'importance d'examiner quels composants cellulaires dans le microenvironnement tumoral absorbent les nanoparticules d'or et deviennent radiosensibilisés. Nous nous intéressons particulièrement aux cellules appelées fibroblastes activés, qui sont associées à la cicatrisation des plaies et ont des propriétés anti-tumorales, ce qui signifie qu'ils aident à combattre la croissance tumorale.
Cependant, les fibroblastes activés peuvent être recrutés par les cellules tumorales, et devenir des fibroblastes associés au cancer (CAF). Au lieu de propriétés anti-tumorales, Les CAF favorisent la prolifération et la métastase des tumeurs.
La fonction des CAF soutient l'idée que les tumeurs sont « des plaies qui ne guérissent pas, " et le ciblage des CAF peut s'avérer bénéfique pour l'amélioration des résultats du traitement du cancer.

Accumulation de nanoparticules d'or (rouge) dans l'environnement tumoral. Crédit :Bromma et al. (2020), Rapports Sci, dix, 2181., Auteur fourni
Comme illustré dans l'image ci-dessus, nos recherches sur l'incorporation de nanoparticules d'or dans les protocoles actuels de radiothérapie avaient trois objectifs :améliorer la destruction des cellules tumorales, cibler les CAF et protéger les fibroblastes.
Pour que la radiosensibilisation soit efficace dans l'amélioration de la radiothérapie, les cellules ciblées par le traitement (celles associées à la croissance du cancer) doivent avoir une forte absorption des particules radiosensibilisantes, tandis que les cellules bénéfiques doivent avoir une faible absorption. Cela rend les cellules ciblées plus facilement détruites par la radiothérapie à des doses que les patients peuvent tolérer.
Ces résultats utilisant des tumeurs 3D cultivées en laboratoire sont très encourageants. Les CAF avaient la plus grande absorption de nanoparticules d'or par cellule, avec presque le triple de celui des cellules cancéreuses, tandis que les fibroblastes avaient un nombre relativement petit. Cela s'est également traduit par une augmentation plus importante des dommages à l'ADN dans les CAF par rapport aux autres types de cellules, réduire l'activité des CAF et ralentir la croissance tumorale.
Cette différence dans les dommages à l'ADN dus au ciblage sélectif des cellules associées au cancer par rapport aux cellules normales peut permettre aux nanoparticules d'or d'être un outil efficace dans la future radiothérapie du cancer, aider à minimiser les dommages aux tissus normaux tout en améliorant la dose de radiothérapie locale à la tumeur.
Cette étude montre que l'utilisation de nanoparticules d'or comme radiosensibilisateur permet de propager davantage de dommages aux CAF, un élément qui s'est avéré largement influent sur la progression du cancer. Nous pensons que ce travail sera une pierre angulaire vers un régime de traitement plus efficace dans un proche avenir. Construire un modèle qui peut représenter avec précision les différentes interactions qui se déroulent à l'intérieur du microenvironnement de la tumeur est essentiel pour améliorer les résultats du traitement pour les patients.
Cet article est republié à partir de The Conversation sous une licence Creative Commons. Lire l'article original. 