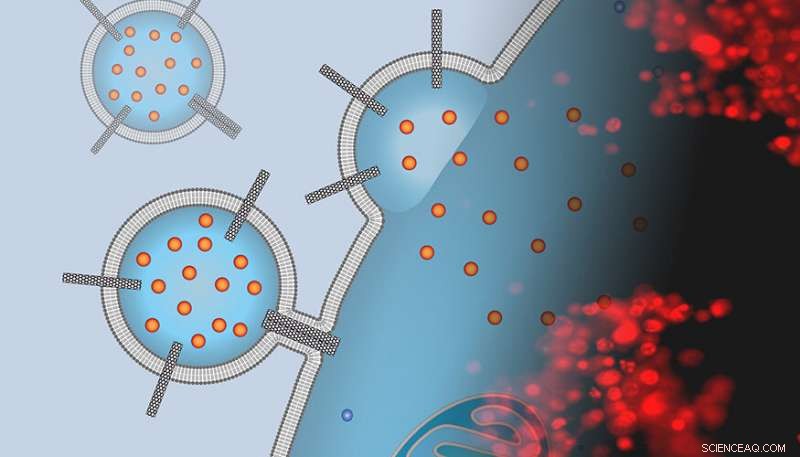
L'image est un montage de la représentation d'un artiste d'un transporteur de médicament liposomal parsemé de porines de nanotubes de carbone qui s'amarre à la surface d'une cellule cancéreuse et délivre une cargaison de chimiothérapie avec une image de microscopie à fluorescence des cellules colorées exposées à ces transporteurs. La tache rouge indique que les cellules sont mortes et que le traitement a réussi. Crédit : P. Lastrico de MPI et N.T. Ho et A. Noy de LLNLL
La médecine moderne s'appuie sur un vaste arsenal de médicaments pour lutter contre des maladies mortelles telles que la pneumonie, tuberculose, VIH-SIDA et paludisme. Les agents de chimiothérapie ont prolongé la vie de millions de patients atteints de cancer, et dans certains cas, guéri la maladie ou l'a transformée en une maladie chronique.
Mais l'introduction de ces médicaments dans des cellules infectées par la maladie est restée un défi majeur pour la pharmacologie et la médecine modernes. Pour faire face à cette difficulté, Lawrence Livermore National Laboratory (LLNL) et les scientifiques et collaborateurs de l'Université de Californie Merced de l'Institut Max Planck de biophysique en Allemagne ont utilisé des nanotubes de carbone pour permettre l'administration directe de médicaments à partir de liposomes à travers la membrane plasmique à l'intérieur de la cellule en facilitant la fusion de la membrane porteuse avec la cellule. La recherche apparaît dans le Actes de l'Académie nationale des sciences .
Les médicaments sont souvent peu solubles, fortement toxique pour d'autres tissus ou subir une dégradation rapide dans les différents environnements chimiques d'un organisme. Ils peuvent s'accumuler dans les tissus non ciblés, se lient à d'autres composants cellulaires ou peuvent ne pas s'internaliser efficacement dans les cellules cibles.
Les systèmes d'administration liposomale visent à atténuer ces problèmes en encapsulant des médicaments dans des supports externes qui circulent dans la circulation sanguine. Cependant, ces systèmes impliquent un compromis entre l'amélioration de la stabilité liposomale sur le chemin de la cible et la libération de la charge utile dans le cytosol de la cellule cible.
La plupart des stratégies d'administration liposomale actuelles reposent sur la voie endosomale pour l'entrée cellulaire, ce qui est intrinsèquement inefficace et entraîne souvent la dégradation du médicament. Lipides cationiques couramment utilisés, qui améliorent la fusion liposomale avec la membrane cible et améliorent l'échappement endosomal, avéré être toxique.
"Nous pensions que les porines des nanotubes de carbone - de courts morceaux de nanotubes de carbone insérés dans des membranes lipidiques - pouvaient imiter la fonctionnalité des peptides de fusion virale et aider à fusionner les transporteurs liposomaux aux membranes des cellules cancéreuses, " a déclaré le scientifique Alex Noy, qui a dirigé la recherche au LLNL.
Dans une série d'expériences, l'équipe a démontré qu'une simple plate-forme de nanomatériaux - un dimère de porines de nanotubes de carbone de petit diamètre (CNTP) - fonctionne comme un puissant promoteur de la fusion membranaire. De plus, lorsque Noy et son équipe ont chargé leurs liposomes d'un puissant agent chimiothérapeutique (doxorubicine), ces transporteurs ont délivré le médicament aux cellules cancéreuses, tuant la majorité d'entre eux.
"Nos résultats ouvrent la voie à des vecteurs d'administration de médicaments simples et efficaces compatibles avec un large éventail de thérapeutiques, " dit Nga Ho, chercheur postdoctoral au LLNL et co-premier auteur de l'article.
Simulations de dynamique moléculaire à gros grains, interprété par l'équipe de Max Planck, a révélé un mécanisme de fusion distinct et inhabituel où les dimères CNTP attachent les vésicules, tirez les membranes à proximité, puis fusionnez leurs feuillets externes et internes.
« Nous avons été très heureux de voir que la fusion membranaire facilitée par les porines de nanotubes de carbone de petit diamètre peut conduire à un mélange complet du matériau de la membrane et du contenu intérieur des vésicules, " a déclaré Marc Siggel, un étudiant diplômé chez Max Planck, et co-premier auteur de l'étude.
"Nos expériences démontrent que les liposomes cloutés de CNTP peuvent servir de base à la construction du mais jusqu'ici insaisissable, support polyvalent pour l'administration directe et hautement efficace de médicaments et de vaccins à ADN et ARN à travers la membrane plasmique, " dit Noy.
"Cette stratégie pourrait contourner entièrement la voie endocytotique et ainsi éviter certains des problèmes rencontrés par les stratégies d'administration précédentes, " a ajouté Gerhard Hummer, biophysicien théoricien à l'Institut Max Planck, qui a dirigé l'effort de modélisation.