Vue schématique du cisaillement de feuilles 2D en nanoruban.
L'un des plus grands défis pour rendre la production d'hydrogène propre et bon marché a été de trouver un catalyseur alternatif nécessaire à la réaction chimique qui produit le gaz, un qui est beaucoup moins cher et abondant que le platine très cher et rare qui est actuellement utilisé. Des chercheurs coréens ont maintenant trouvé un moyen de « découper » en minuscules nanorubans une substance bon marché et abondante qui correspond à la facture, augmentant son efficacité catalytique à au moins celle du platine.
Les chercheurs ont identifié une alternative potentielle aux catalyseurs – et une manière innovante de les produire à l'aide de « ciseaux » chimiques – qui pourraient rendre la production d'hydrogène plus économique.
L'équipe de recherche dirigée par le professeur Sang Ouk Kim du Département de science et génie des matériaux a publié ses travaux dans Communication Nature .
L'hydrogène est susceptible de jouer un rôle clé dans la transition propre loin des combustibles fossiles et d'autres processus qui produisent des émissions de gaz à effet de serre. Il existe une multitude de secteurs des transports, tels que le transport maritime long-courrier et l'aviation, qui sont difficiles à électrifier et nécessiteront donc de l'hydrogène proprement produit comme carburant ou comme matière première pour d'autres carburants synthétiques neutres en carbone. De même, il est peu probable que la production d'engrais et le secteur de l'acier soient « décarbonisés » sans hydrogène bon marché et propre.
Le problème est que les méthodes de loin les moins chères pour produire de l'hydrogène gazeux sont actuellement à partir du gaz naturel, un processus qui produit lui-même le dioxyde de carbone, un gaz à effet de serre, ce qui va à l'encontre de l'objectif.
Techniques alternatives de production d'hydrogène, comme l'électrolyse utilisant un courant électrique entre deux électrodes plongées dans l'eau pour surmonter les liaisons chimiques qui maintiennent l'eau ensemble, le divisant ainsi en ses éléments constitutifs, l'oxygène et l'hydrogène sont très bien établis. Mais l'un des facteurs contribuant au coût élevé, au-delà d'être extrêmement énergivore, est le besoin de platine, un métal précieux et relativement rare, très cher. Le platine est utilisé comme catalyseur - une substance qui déclenche ou accélère une réaction chimique - dans le processus de production d'hydrogène.
Par conséquent, les chercheurs sont depuis longtemps à la recherche d'un substitut au platine, un autre catalyseur abondant dans la terre et donc beaucoup moins cher.
dichalcogénures de métaux de transition, ou TMD, sous forme de nanomatériau, ont été considérés pendant un certain temps comme un bon candidat comme catalyseur de remplacement du platine. Ce sont des substances composées d'un atome d'un métal de transition (les éléments de la partie médiane du tableau périodique) et de deux atomes d'un élément chalcogène (les éléments de l'avant-dernière colonne du tableau périodique, spécifiquement le soufre, sélénium et tellure).
Ce qui fait des TMD un bon pari en remplacement du platine, ce n'est pas seulement qu'ils sont beaucoup plus abondants, mais aussi leurs électrons sont structurés d'une manière qui donne un coup de pouce aux électrodes.
En outre, un TMD qui est un nanomatériau est essentiellement une feuille super-mince bidimensionnelle de seulement quelques atomes d'épaisseur, tout comme le graphène. La nature ultrafine d'une nanofeuille TMD 2-D permet d'exposer beaucoup plus de molécules TMD pendant le processus de catalyse que ce ne serait le cas dans un bloc de l'étoffe, démarrant et accélérant ainsi encore plus la réaction chimique produisant de l'hydrogène.
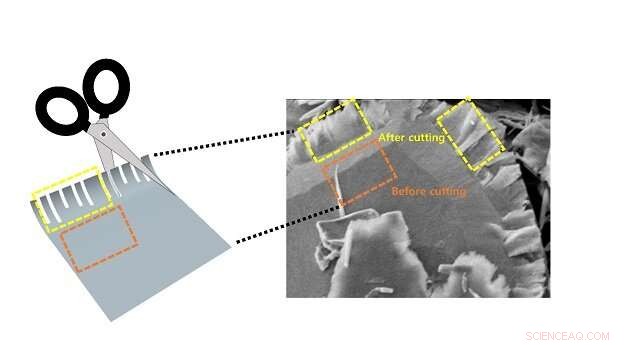
Cependant, même ici, les molécules TMD ne sont réactives qu'aux quatre bords d'une nanofeuille. Dans l'intérieur plat, il ne se passe pas grand chose. Afin d'augmenter la vitesse de réaction chimique dans la production d'hydrogène, la nanofeuille devrait être découpée en très fines bandes presque unidimensionnelles, créant ainsi de nombreux bords.
En réponse, l'équipe de recherche a développé ce qui est essentiellement une paire de ciseaux chimiques qui peuvent couper le TMD en minuscules lanières.
"Jusqu'à maintenant, les seules substances que quelqu'un a pu transformer en ces "nano-rubans" sont le graphène et le phosphorène, " a déclaré le professeur Sang Kim, l'un des chercheurs impliqués dans la conception du processus.
"Mais ils sont tous les deux constitués d'un seul élément, donc c'est assez simple. Comprendre comment le faire pour TMD, qui est fait de deux éléments allait être beaucoup plus difficile."
Les « ciseaux » comprennent un processus en deux étapes consistant à insérer d'abord des ions lithium dans la structure en couches des feuilles TMD, puis en utilisant des ultrasons pour provoquer un "décompression" spontané en lignes droites.
« Cela fonctionne un peu comme lorsque vous fendez une planche de contreplaqué :elle se casse facilement dans une direction le long du fil, " continua le professeur Kim. " C'est en fait très simple. "
Les chercheurs l'ont ensuite essayé avec différents types de TMD, y compris ceux en molybdène, sélénium, soufre, tellure et tungstène. Tout fonctionnait aussi bien, avec une efficacité catalytique aussi efficace que celle du platine.
En raison de la simplicité de la procédure, cette méthode devrait pouvoir être utilisée non seulement dans la production à grande échelle de nanorubans TMD, mais aussi pour fabriquer des nanorubans similaires à partir d'autres matériaux 2-D multi-élémentaires à des fins autres que la simple production d'hydrogène.