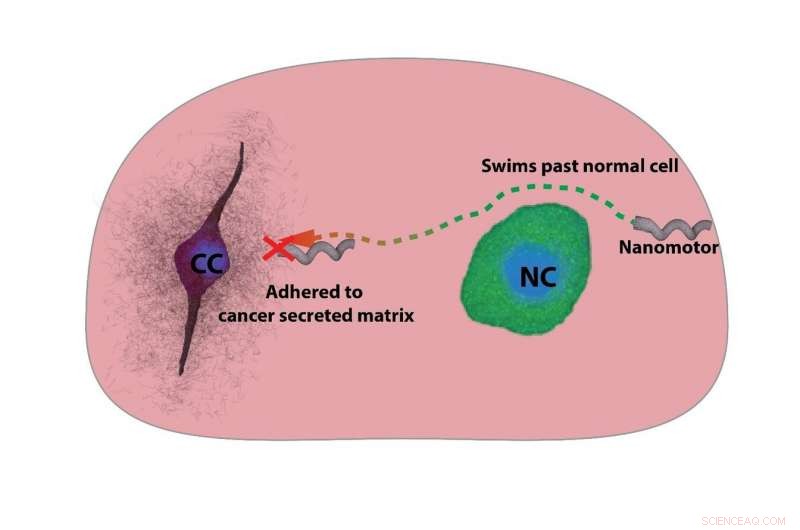
Les nanomoteurs peuvent nager au-delà des cellules non cancéreuses mais adhérer à la matrice chargée du cancer sécrétée dans un modèle tumoral. Cela peut être utilisé pour localiser un essaim de nanomoteurs près des cellules cancéreuses dans une tumeur Crédit :Debayan Dasgupta
Une équipe interdisciplinaire de chercheurs de l'Institut indien des sciences (IISc) a utilisé un modèle de tumeur en 3D et des nanomoteurs à entraînement magnétique pour sonder le microenvironnement des cellules cancéreuses. L'équipe est composée de chercheurs du Center for Nano Science and Engineering (CeNSE) et du Département de reproduction moléculaire, Développement et génétique (MRDG).
Dans leur travail, Publié dans Angewandte Chemie , l'équipe a piloté des nanomoteurs hélicoïdaux à distance via un champ magnétique externe à travers le modèle tumoral pour détecter, cartographier et quantifier les changements dans l'environnement cellulaire. Le modèle comprend à la fois des cellules saines et cancéreuses intégrées dans une matrice de membrane basale reconstituée, et imite l'environnement du cancer du sein.
L'étude met en évidence une nouvelle façon de cibler les cellules cancéreuses en manœuvrant des nanomoteurs à l'intérieur d'une tumeur et en attendant qu'elles se localisent à proximité du site cancéreux. "Nous avons essayé de diriger les nanomoteurs vers les cellules cancéreuses dans un modèle de tumeur et les avons observés se coller à la matrice près des cellules cancéreuses, mais cela n'a pas été observé près des cellules normales, " dit Debayan Dasgupta, un co-premier auteur et Ph.D. étudiant au CeNSE.
La matrice extracellulaire (MEC) est un réseau 3-D complexe de protéines et de glucides sécrétés par les cellules vivantes dans leur voisinage. Cependant, lorsque les cellules cancéreuses sécrètent du matériel frais dans l'ECM, il perturbe la composition chimique et physique de la MEC native entourant les cellules saines, dégrader l'environnement local. Par conséquent, comprendre comment le microenvironnement cellulaire est altéré en raison des cellules cancéreuses et mesurer ces changements quantitativement pourrait être essentiel pour comprendre la progression du cancer.
Dans l'étude actuelle, les chercheurs ont découvert qu'à mesure que les nanomoteurs s'approchaient de la membrane des cellules cancéreuses, ils se sont collés à la matrice plus fortement qu'ils ne le feraient à des cellules normales. Pour mesurer la force des nanomoteurs liés à la matrice, l'équipe a calculé l'intensité du champ magnétique nécessaire pour surmonter la force d'adhérence, et avancer.
"Cela signifie que les cellules cancéreuses font quelque chose. Alors, nous avons fait quelques mesures et découvert que cela [la force d'adhérence] dépendait du type de cellules, la force de l'interaction et aussi de quel côté de la cellule le nanomoteur s'est approché, " explique Ambarish Ghosh, Professeur agrégé au CeNSE et l'un des auteurs principaux. "À la fin, nous avons vraiment fini par découvrir une propriété physique d'un environnement biologique important."
La raison pour laquelle les nanomoteurs semblent mieux coller aux cellules cancéreuses est leur ECM chargée. Cela peut être dû à la présence de 2, acide sialique 3-lié, une molécule conjuguée au sucre qui confère une charge négative à l'environnement des cellules cancéreuses, les chercheurs ont trouvé. Ils ont visualisé la distribution de ces sucres à l'aide de marqueurs fluorescents et ont découvert que les acides sialiques étaient distribués jusqu'à 40 micromètres de la surface des cellules cancéreuses – la même distance jusqu'à laquelle les nanomoteurs ont connu une forte adhérence.
Pour contrer cet effet adhésif, l'équipe a recouvert les nanomoteurs de perfluorooctyltriéthoxysilane (PFO) qui les a protégés de l'environnement chargé. Les nanomoteurs revêtus ne collaient pas à la matrice près des cellules cancéreuses, alors que les moteurs non revêtus s'accrochaient à la matrice, confirmant le fait que le microenvironnement cancéreux chargé négativement interagit avec les nanomoteurs entrants, les rendant immobiles.
"Ce qui a été une belle surprise, c'est qu'au sein d'un tel milieu, nous avons découvert que les cellules cancéreuses agressives finissaient par remodeler leur environnement en les rendant plus collantes, et plus riche en sucres chargés spécifiques, " dit Ramray Bhat, Professeur adjoint au MRDG et l'un des auteurs principaux. "Cette charge peut potentiellement être utilisée pour cibler et tuer de minuscules populations de cellules cancéreuses cachées parmi leurs homologues normales, pour laquelle nous étendons ces études aux animaux vivants.