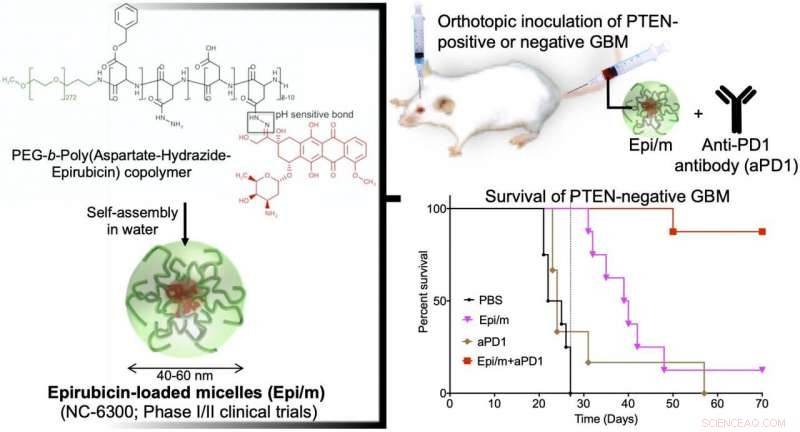
À gauche :l'épirubisine hydrophobe est conjuguée à une extrémité de la chaîne de polyéthylène glycol (PEG) hydrophile avec l'aspartate-hydrazide comme lieur. Dans l'eau, cette molécule s'auto-assemble pour former des nano-micelles (Epi/m). En haut à droite :PTEN(+) ou PTEN(-) GBM a été transplanté dans le cerveau de souris, et Epi/m et des anticorps anti-PD1 (aPD1) ont été administrés par la veine caudale pour évaluer la période de survie. En bas à droite :Comparaison de la période de survie en cas de PTEN(-)GBM. Du PBS (solution tampon phosphate) a été administré au groupe témoin. Par conséquent, aucun membre du groupe témoin (noir) n'a pu survivre plus de 30 jours (8/8). Le groupe Epi/m seul (rose) est décédé progressivement après 30 jours, la moitié (4/8) en 40 jours, et 7/8 par 50 jours. aPD1 seul (brun) a tué 6/7 en 30 jours. En revanche, en utilisant Epi/m+aPD1 (rouge), 1/8 est décédé 50 jours plus tard, mais 7/8 étaient vivants après 3 mois même. Crédit :2020 Centre d'innovation de la nanomédecine
Une stratégie basée sur la nanomédecine pour la chimio-immunothérapie (CIT) du glioblastome (GBM), qui a le pire pronostic parmi les tumeurs cérébrales, a été développé avec succès. Des expériences in vivo ont démontré que l'utilisation combinée de nano-micelles d'encapsulation d'épirubicine (Epi/m) avec des inhibiteurs de point de contrôle immunitaire (ICI) a éradiqué le GBM PTEN-négatif, qui est très résistant à l'ICI seul. En raison des effets synergiques de la combinaison Epi/m plus ICI, le nombre de cellules T infiltrant la tumeur (TIL) et d'autres cellules immunitaires antitumorales a considérablement augmenté pour tuer efficacement les cellules cancéreuses.
D'autre part, cellules immunosuppressives intratumorales dérivées de la moelle osseuse (MDSC), qui interfèrent avec la réponse immunitaire, ont été considérablement réduits. Le CIT a également fourni des effets de mémoire immunologique robustes contre les tumeurs, qui a effectivement rejeté les cellules GBM PTEN-négatives nouvellement implantées dans le cerveau. Alors que l'épirubicine libre peut endommager les organes, notamment les organes hématopoïétiques, notre stratégie de nanomédecine a considérablement réduit ces effets secondaires, améliorer la réponse immunitaire. Epi/m a déjà avancé dans les essais cliniques pour d'autres types de cancer, et cette stratégie CIT pourrait être traduite en évaluation clinique à l'avenir. Ces résultats ont été publiés dans ACS Nano le 6 août par l'American Chemical Society.
Le Centre d'Innovation de la Nanomédecine (Directeur :Prof. Kazunori Kataoka, Lieu :Kawasaki-Ville, Abréviation :iCONM) a annoncé qu'une nouvelle option thérapeutique pour le glioblastome (GBM) a été démontrée chez la souris, dans une étude de collaboration avec le Département de Bio-ingénierie, Ecole Supérieure d'Ingénieurs, L'Université de Tokyo. Le GBM est une tumeur cérébrale d'évolution extrêmement rapide et de mauvais pronostic (taux de survie à 5 ans :10,1 %). Bien que plusieurs composés soient évalués dans des études cliniques, il n'y a pas d'option thérapeutique pour améliorer significativement la période de survie. En particulier, les patients présentant des anomalies du gène PTEN, l'un des gènes suppresseurs de cancer, sont très résistants aux thérapies actuellement disponibles et ont des besoins médicaux élevés.
En général, les inhibiteurs de point de contrôle immunitaire (ICI) sont considérés comme inefficaces contre le GBM, car le GBM est immunosuppresseur avec une faible infiltration de lymphocytes T. Dans la méthode présentée dans cet article, La technologie d'administration de nano-médicaments d'iCONM permet une accumulation tumorale sélective d'épirubicine, qui provoque la mort cellulaire immunogène (ICD), aux tissus tumoraux, ainsi, provoquant l'ICD localement pour la synergie avec ICI. Par conséquent, cette chimio-immunothérapie (CIT) basée sur la nanomédecine a été efficace chez des souris transplantées avec GBM dans le cerveau (ci-après dénommé modèle de souris GBM), et a réussi à prolonger considérablement la survie des souris. La combinaison des souris traitées aux nano-micelles chargées d'épirubicine a montré une infiltration élevée de cellules T cytotoxiques (TIL) et une diminution des cellules immunosuppressives dérivées de la moelle osseuse (MDSC). Finalement, la suppression de la fonction de point de contrôle immunitaire a été observée.
Des mutations du gène PTEN surviennent fréquemment dans le GBM, résultant en des voies immunosuppressives qui favorisent la résistance aux ICI. Ainsi, tandis que les ICI ont éradiqué 40 % des tumeurs dans un modèle de souris GBM dans lequel le gène PTEN est normal, dans un modèle dans lequel le gène PTEN a été désactivé, Les ICI n'ont pas pu prolonger la survie des souris. Au niveau cellulaire, il a été constaté que les cellules déficientes en PTEN (CT2A-luc) exprimaient environ 5 fois plus de PDL1 que les cellules normales, ce qui est probablement lié à la résistance thérapeutique aux ICI. Comme l'épirubicine a montré sa capacité à supprimer l'expression de PDL1 dans les tumeurs, comme le cancer du sein, il serait possible de diminuer les niveaux de PDL1 de GBM si une quantité suffisante d'épirubicine peut être délivrée dans les lésions de GBM. Ainsi, CIT utilisant des nanomicelles contenant de l'épirubicine (Epi/m) en combinaison d'ICI ont été utilisés pour améliorer l'efficacité antitumorale contre GBM.
Dans un modèle GBM avec une expression PTEN normale (GL261-luc), Epi/m (5 mg/kg sur la base Epi) plus des anticorps anti-PD1 (5 mg/kg) ont entraîné la survie de toutes les souris pendant plus de 70 jours, avec une prolongation remarquable du temps de survie. Dans ce modèle, Les souris traitées au PBS sont mortes dans les 30 jours, les souris traitées avec des anticorps anti-PD1 seuls (5 mg/kg) ont permis à 40 % des souris de survivre au moins 70 jours, et Epi/m (5 mg/kg de base Epi) ont entraîné une survie de 80 % des souris pendant plus de 70 jours. En revanche, dans le modèle déficient en PTEN (CT2A-luc), Epi/m (5 mg/kg sur la base Epi) plus des anticorps anti-PD1 (5 mg/kg) n'ont entraîné que 30% de la survie des souris pendant plus de 70 jours, et aucun effet de survie clair n'a pu être confirmé pour les autres groupes témoins. Lorsque la dose a été augmentée à 15 mg/kg d'Epi/m² (en base Epi) et associée à des anticorps anti-PD1 (5 mg/kg), 90% des souris ont pu survivre plus de 70 jours, prolongeant remarquablement la survie des souris.