
Application in vitro du dosage utilisant plusieurs types de cellules avec simulation et extraction de taux. (A) Données de fluorescence et configuration d'essai représentant la fluorescence QD (QSH) non lavée pour les puits non lavés qui contiennent des reins (MES13), foie (AML12), endothélial (C166), et les types de cellules macrophages (J774a.1). UA, unités arbitraires. (B) Concentrations d'absorption de fluorescence brute (noir) et calibrée (rouge) lavées (cercles, mesurée) par rapport aux ajustements de simulation (lignes) pour le foie, endothélial, macrophage, et les types de cellules rénales. (C) Résumé des constantes de vitesse optimisées par l'algorithme génétique pour l'ajustement du modèle aux ensembles de données mesurés. (D) Images de microscopie confocale dépendantes du temps de l'absorption QD, montrant la saturation (flèches recto-verso) pour chaque type de cellule dans l'étude (le bleu et le rouge représentent le noyau cellulaire Hoechst et la fluorescence QSH, respectivement). Le dessin animé est une représentation visuelle de la cinétique d'interaction QD-cellule. Crédit: Avancées scientifiques , doi:10.1126/sciadv.aax2642
Les bio-ingénieurs peuvent concevoir des médicaments intelligents pour les thérapies à base d'anticorps et de nanomatériaux afin d'optimiser l'efficacité des médicaments pour des traitements de plus en plus efficaces, essais précliniques à un stade précoce. Le médicament idéal aura une efficacité maximale sur les sites tissulaires cibles pour le transport de la vascularisation tissulaire à l'environnement cellulaire. Les chercheurs peuvent utiliser des simulations biologiques couplées à des approches in vitro pour prédire leur exposition rapidement et efficacement afin de prédire la biodistribution des médicaments dans des cellules individuelles de tissus animaux vivants sans s'appuyer sur des études animales. Dans une nouvelle étude maintenant publiée sur Avancées scientifiques , Edward Price et Andre J. Gesquiere ont utilisé avec succès un essai in vitro et un modèle de dynamique des fluides computationnelle (CFD) pour traduire la cinétique cellulaire in vitro en simulations du corps entier sur plusieurs espèces et types de nanomatériaux. Le travail leur a permis de prédire les distributions de médicaments à l'intérieur des cellules tissulaires individuelles et l'équipe s'attend à ce que ce travail s'affine, réduire et remplacer les tests sur les animaux tout en offrant aux scientifiques une nouvelle perspective sur le développement de médicaments.
Les nanomédicaments (NM) sous forme d'anticorps et de nanomatériaux synthétiques peuvent compléter la médecine conventionnelle à petites molécules grâce au ciblage actif des tissus, des délais et stabilité de circulation variables, couplé à une biodistribution réglable. Les équipes de recherche s'appuient fortement sur des modèles animaux pour quantifier les doses délivrées, soulevant des questions sur l'éthique et les augmentations de temps et de coûts. D'un point de vue scientifique, La destruction de l'architecture tissulaire menée pendant l'homogénéisation des tissus pour la quantification peut éliminer les connaissances essentielles sur le transport de la nanomédecine à l'intérieur des cellules tissulaires et du système vasculaire. Un médicament peut atteindre les cellules en présentant une pharmacocinétique plasmatique optimale pour atteindre le système vasculaire tissulaire. L'architecture et le diamètre des nanoparticules permettent un transport critique du médicament à travers les parois des microvaisseaux dans un environnement cellulaire tissulaire infecté ou normal.
Dans le travail present, Price et Gesquiere ont couplé une approche de simulation in vitro/in silico pour prédire la biodistribution des NM au sein d'espèces précliniques (modèles animaux et cellulaires) au niveau de la cellule unique. Ils ont expliqué les différences de taille des nanoparticules, espèces animales et diamètres de la taille des pores du système vasculaire à l'aide d'un modèle de dynamique des fluides. L'équipe a quantifié le contenu cellulaire NM dans des situations où les résultats étaient difficiles à traduire en études animales en raison d'un manque de perspectives systématiques. Ils ont également abordé les problèmes expérimentaux existants où les cellules induisaient une dégradation de la fluorescence des nanoparticules pour produire de faux négatifs.
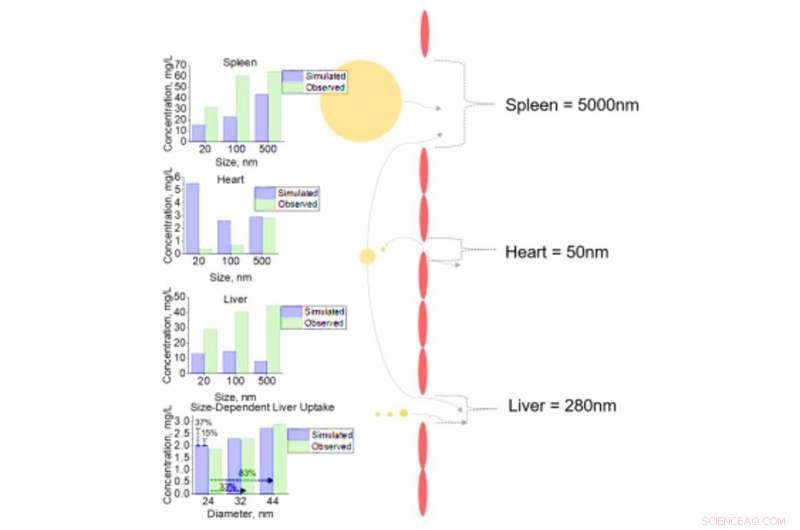
Analyse cellulaire de l'absorption de NM dans divers tissus pour NM avec différents diamètres. Absorption cellulaire de NM de diamètre 20, 100, et 500 nm pour la rate, cœur, et foie avec des diamètres de fenêtres de 5000, 50, et 280 nm respectivement. Analyse de sensibilité des changements incrémentiels du diamètre NM (24, 32, et 44 nm) avec une capture ultérieure des cellules hépatiques ont été effectuées. Toutes les sorties simulées (prédites) sont comparées aux données observées des ensembles de données cellulaires de la littérature. Crédit: Avancées scientifiques , doi:10.1126/sciadv.aax2642
Pour valider leur travail in vitro, l'équipe a simulé l'analyse lysosomale couplée à la spectroscopie d'absorption atomique (AAS), et étayé des simulations in vivo en comparant les résultats à la littérature publiée des données animales du corps entier pour les rats, souris et primates non humains. Les scientifiques ont utilisé les points quantiques (QD) comme système modèle en raison de leur potentiel de détection de nanoparticules, tout en considérant leurs limites. Prix et al. a pris en compte les complexités d'une plate-forme NM pour étendre les capacités aux nanoparticules à base d'anticorps et de métal/polymère.
Lorsqu'une nanoparticule circule dans le sang animal pour pénétrer dans l'environnement tissulaire, il interagira avec les cellules tissulaires par adsorption, désorption, processus d'internalisation ou d'adoption active. Les scientifiques ont exposé des nanoparticules à des QD (points quantiques) non toxiques pour détecter par fluorescence leurs interactions avec des cellules couramment rencontrées par les nanomatériaux tels que les macrophages, cellules endothéliales et cellules épithéliales, après injection intraveineuse. L'équipe de recherche a quantifié la concentration de nanoparticules interagissant avec les cellules in vitro et construit des simulations de cinétique cellulaire pour évaluer la cinétique de vitesse et les interactions NM-cellule.
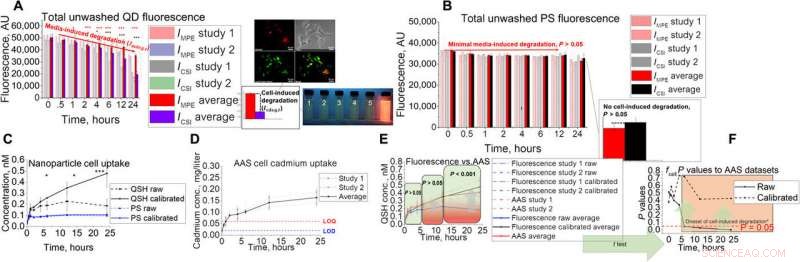
Développement d'essais in vitro et validation pour AAS. (A et B) Configuration d'essai in vitro avec son signal de fluorescence couplé non lavé pour (A) QD et (B) PS. Les images montrent la colocalisation Hepa1-6 de QD dans les compartiments lysosomal ainsi que des instantanés de fluorescence sous éclairage ultraviolet dans des conditions d'exposition lysosomale simulées avec un pH de 2,5, 3.0, 3.5, 4.0, 4.5, et 7,4 (1 à 6, respectivement). (C à E) études de captation QD utilisant la technique in vitro avec (C) fluorescence, (D) SAA, (E) combiné, et les résultats statistiques (F) utilisant le test t bilatéral lors de la comparaison de l'absorption de fluorescence brute et calibrée aux données AAS. Les astérisques dans la figure représentent la signification au * (P <0,05), ** (P <0,01), et *** (P <0,001). Crédit: Avancées scientifiques , doi:10.1126/sciadv.aax2642
La simulation contenait un (i) milieu, (ii) la membrane cellulaire et (iii) les compartiments de l'espace cellulaire interconnectés via des équations de transfert de masse de base et des constantes de vitesse de premier ordre. Ils ont optimisé le système à l'aide d'un algorithme génétique dans MATLAB et ont noté que la constante de vitesse d'adsorption membranaire était la plus élevée pour les macrophages et la plus faible pour les cellules endothéliales et hépatiques. Parmi les types cellulaires, le processus d'internalisation était également relativement le plus élevé pour les cellules du tissu hépatique et le plus faible pour les cellules endothéliales. L'imagerie confocale a soutenu visuellement ces données avec une absorption et une saturation rapides des macrophages dans l'heure suivant l'exposition, tandis que les cellules des tissus épithéliaux et endothéliaux ont été davantage retardées.
L'équipe a démontré la présence de facteurs de dégradation cellulaire dans les essais in vitro en utilisant des simulations de cinétique cellulaire pour aider à traduire efficacement les données in vitro en études animales. La spectroscopie d'adsorption atomique (AAS) a validé les résultats de l'absorption QD via des tests de fluorescence et a souligné l'importance du calcul de la dégradation induite par les cellules et le milieu. Étant donné que les nanomédicaments (NM) situés à l'intérieur des tissus peuvent s'accumuler dans les interstitiels, vasculaire ou à l'intérieur d'une variété de types de cellules, l'équipe a traduit la cinétique cellulaire in vitro en simulations animales in silico pour en tenir compte. Ils ont mené deux études pilotes et évalué les tendances de l'absorption par les tissus entiers en fonction de la taille et l'absorption quantifiée de NM au niveau de la cellule unique. Architecturalement, chaque simulation de compartiment tissulaire contenait quatre sous-compartiments pour représenter l'épithélial, cellules endothéliales et macrophages.
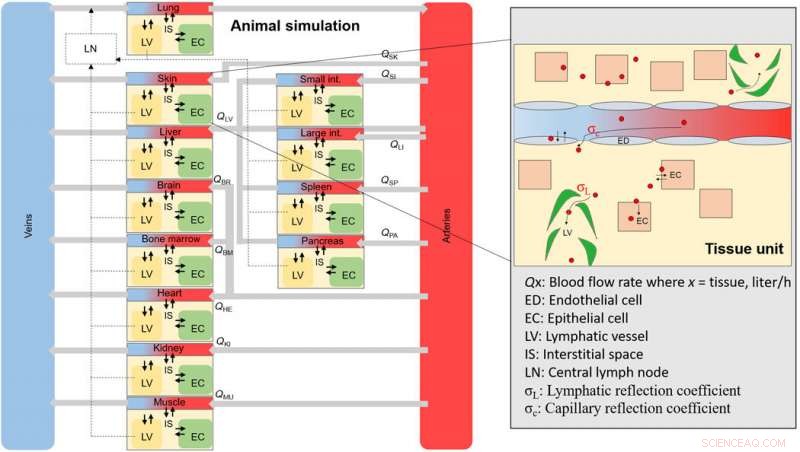
Un schéma général de la simulation NM animale. Schéma de l'ensemble des compartiments tissulaires et sanguins qui composent l'animal complet. Chaque compartiment tissulaire est interconnecté par des débits sanguins et contient des sous-compartiments (zone agrandie), où un NM se distribuera lors de l'internalisation à travers les fenêtres endothéliales. Crédit: Avancées scientifiques , doi:10.1126/sciadv.aax2642
Étant donné que le foie et la rate sont des cibles communes pour l'accumulation de NM, ils ont utilisé ces tissus comme études de cas pour comprendre et capturer, la sensibilité et la précision de la simulation. Par exemple, la simulation a montré que l'augmentation des tailles de NM dépassait la taille des pores des tissus de la plupart des types de tissus pour se diriger vers les tissus avec des pores de plus grande taille tels que le foie. À ce point, les cellules endothéliales du foie ont interagi avec les NM pour une liaison et une saturation rapides de la membrane dans les 24 heures. Lorsque le NM est entré dans les interstitiels du tissu, il a rapidement interagi avec les cellules tissulaires épithéliales (pour le foie) et macrophages (pour la rate). Les résultats ont renforcé la confiance dans le pouvoir prédictif de la simulation et sa capacité à prédire pour la première fois la teneur en médicament de taille variable au niveau d'une seule cellule pour les animaux, strictement sur la base de données in vitro uniquement.
Les scientifiques ont ensuite indiqué le pouvoir prédictif et la capacité de traduction de la simulation en comparant le contenu mesuré au niveau des tissus pour plusieurs types et espèces de NM, y compris les rats, souris et contenu cellulaire (épithélial, endothélial et macrophage). Ils ont testé les performances prédictives sur plusieurs variables sur la base des directives et des normes de l'Organisation mondiale de la santé du consortium universitaire et pharmaceutique pour le développement et la sécurité des médicaments. Les moyennes prédites par le modèle et les moyennes observées sont corrélées linéairement pour indiquer des prévisions de modèle raisonnables pour toutes les espèces et types de NM.
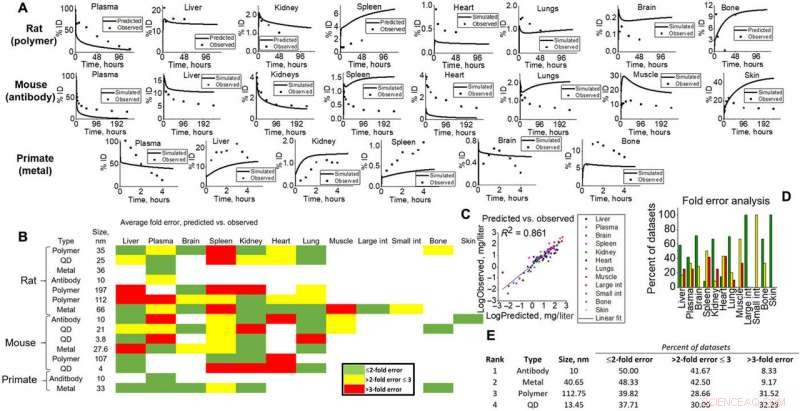
Sorties de simulation pour validation à diverses études animales. (A) Exemples prédits (ligne) au niveau des tissus par rapport aux (points) observés pour tous les types d'espèces (rats, souris, et PSN) pour une preuve visuelle des capacités du modèle. (B) Carte thermique de l'analyse d'erreur de pli calculée pour tous les tissus, NM, et les types d'espèces en simulation. Vert, jaune, et le rouge représente <2 fois, <3 fois, et>3 fois les erreurs. L'erreur de pli a été calculée selon les équations données dans Matériaux et méthodes, où les moyennes des ensembles de données simulées ont été comparées à celles observées. (C) Toutes les moyennes des points de données spécifiques aux types de tissus pour les simulations et observées ont été tracées les unes contre les autres pour donner un ajustement linéaire (R2 =0,861). (D) Des erreurs de pli spécifiques aux tissus sont montrées pour visualiser la précision du modèle pour chaque tissu dans cette étude. (E) Les sorties simulées par NM ont été classées (1 à 4) en fonction de l'analyse d'erreur de pli. Crédit: Avancées scientifiques , doi:10.1126/sciadv.aax2642
De cette façon, Edward Price et Andre J. Gesquiere ont développé une plate-forme viable pour réduire et affiner les tests sur les animaux pendant le développement de la nanomédecine (NM). Les données concentrées in vitro couplées à des simulations de cinétique cellulaire ont fourni des interactions cellule-NM pour montrer un excellent potentiel de traduction. Les résultats n'ont pas nécessité d'ajustement aux ensembles de données de biodistribution animale, puisque tous les paramètres ont été optimisés pour les données in vitro ou calculés à l'aide d'un modèle de dynamique des fluides. Le processus a également fonctionné dans des conditions de dégradation de NM dans l'environnement biologique. Les techniques combinées in vitro et in silico aideront la future conception de médicaments intelligents pour aider les scientifiques à former des discussions meilleures et éclairées tout en réduisant les tests sur les animaux vivants. Price et Gesquiere s'attendent à ce que ce travail serve à une nouvelle approche pour les simulations prédictives du transport de la nanomédecine.
© 2020 Réseau Science X