En combinant des champs magnétiques de faible puissance, qui agite les nanofils, avec chauffage laser et administration de médicaments, les cellules cibles peuvent être tuées efficacement. Crédit :KAUST
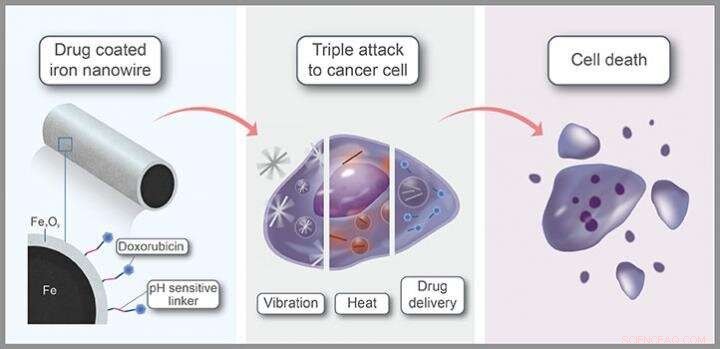
Des nanofils de fer enrobés de médicament qui peuvent être guidés vers le site d'une tumeur à l'aide d'un champ magnétique externe avant d'activer un mécanisme de destruction du cancer en trois étapes pourraient constituer une option efficace pour le traitement du cancer.
Co-développé par les chercheurs du KAUST, ces nanofils libèrent leur cargaison de médicaments à l'intérieur des cellules cancéreuses, tout en perçant des trous dans la membrane de la cellule et en délivrant un souffle de chaleur. Alors que la thérapie combinée maximise la mort des cellules cancéreuses, sa nature très ciblée devrait minimiser les effets secondaires.
Le fer était le matériau évident pour fabriquer les nanofils, dit Jürgen Kosel, qui dirige le groupe chez KAUST, qui comprend Jasmeen Merzaban et Boon Ooi, et qui a co-dirigé les travaux avec les chercheurs du CIC biomaGUNE à San Sebastian, Espagne.
La première considération est la sécurité. "Le fer, sous forme moléculaire, est un matériau natif de notre corps, indispensable au transport de l'oxygène, " explique Kosel. Les nanofils sont constitués d'un noyau de fer, recouvert d'une coquille d'oxyde de fer. « Les nanomatériaux à base d'oxyde de fer ont été approuvés par les organismes de réglementation pour une utilisation en imagerie par résonance magnétique et comme complément alimentaire en cas de carence nutritionnelle, " il dit.
En plus de leur biocompatibilité, les propriétés magnétiques des matériaux à base de fer sont un avantage clé. "En utilisant des champs magnétiques inoffensifs, nous pouvons les transporter; concentrez-les dans la zone souhaitée; les faire pivoter ou les faire vibrer, comme nous l'avons fait dans cette étude ; et même les détecter grâce à l'imagerie par résonance magnétique, " dit Aldo Martínez-Banderas, un membre de l'équipe de Kosel. Application de champs magnétiques de faible puissance, l'équipe a agité les nanofils de manière à ouvrir la membrane des cellules cibles, induisant la mort cellulaire.
L'avantage supplémentaire est que les nanofils noyau-coque absorbent fortement la lumière proche infrarouge, se réchauffer comme ils le font. Parce que la lumière à cette longueur d'onde peut pénétrer loin dans le corps, les nanofils pourraient être chauffés à l'aide de lasers dirigés sur le site de la tumeur. « Les nanofils cœur-coquille ont montré une efficacité de conversion photothermique extrêmement élevée de plus de 80 %, ce qui s'est traduit par une forte dose de chaleur intracellulaire, ", dit Martínez-Banderas.
Finalement, le médicament anticancéreux doxorubicine a été attaché aux nanofils via des lieurs sensibles au pH. Comme l'environnement tumoral est généralement plus acide que les tissus sains, le lieur s'est dégradé sélectivement dans ou à proximité des cellules tumorales, libérer le médicament là où il est nécessaire. « La combinaison de traitements a entraîné une ablation presque complète des cellules cancéreuses et a été plus efficace que les traitements individuels ou le médicament anticancéreux seul, ", dit Martínez-Banderas.
"Pris ensemble, les capacités des nanomatériaux à base de fer les rendent très prometteurs pour la création de nanorobots biomédicaux, qui pourrait révolutionner les soins de santé, " Kosel ajoute. " Bien que cela puisse sembler futuriste, les développements sont en bonne voie."