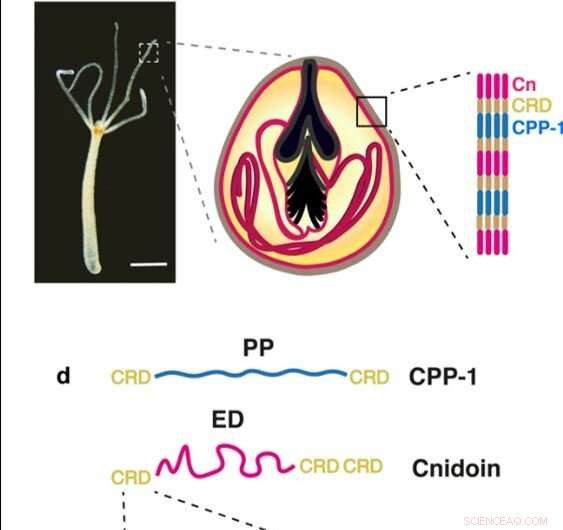
(a) Image en champ clair d'un polype Hydra (barre d'échelle :500 µm). (b) Représentation schématique d'un nématocyste de type sténothèle avec un grand stylet et un tubule enroulé à l'intérieur du corps de la capsule creuse. (c) La paroi de la capsule du nématocyste est constituée de CPP-1 et de Cnidoine (Cn), liés par des domaines riches en cystéine (CRD). (d) CPP-1 a un domaine polyproline (PP) « rigide » flanqué de deux unités CRD, tandis que Cnidoin est constitué d'un "élastique", domaine soyeux (ED) flanqué d'unités CRD. Chaque unité CRD a six résidus cysteine dans un motif conservé (X désigne un résidu non cysteine). Crédit :Rapports scientifiques, doi:10.1038/s41598-019-55655-0
Les nématocystes sont des organites urticants des cnidaires qui ont des propriétés mécaniques remarquables pour subir des changements de volume de 50 pour cent au cours de l'exocytose explosive (processus par lequel les cellules excrètent les déchets et les grosses molécules), tout en résistant à des pressions osmotiques supérieures à 100 bars. Les chercheurs ont récemment identifié deux nouveaux composants protéiques qui ont construit la paroi du nématocyste à Hydra pour inclure (1) une protéine cnidaire riche en proline-1 (CPP-1) avec un motif polyproline rigide, et (2) une Cnidoine élastique possédant un domaine semblable à de la soie. Dans une nouvelle étude, maintenant sur Rapports scientifiques , Theresa Bentele et une équipe de chercheurs des départements de médecine, Evolution moléculaire et génomique et l'Institut de chimie physique en Allemagne, Australie et Japon, ont exprimé les protéines recombinantes Cnidoine et CPP-1 dans Escherichia coli .
Ils ont comparé le module d'élasticité de protéines en vrac spontanément réticulées avec celui de nématocystes isolés. Les chercheurs ont systématiquement optimisé la fabrication de nanofibres de protéines uniformes en utilisant des conditions d'électrofilage et de préparation. Les deux fibres sont restées stables même après un lavage rigoureux et une immersion dans l'eau en vrac, en raison de la réticulation simultanée de domaines riches en cystéine. Les nanofibres résultantes étaient clairement différentes des autres nanofibres protéiques qui étaient instables sans procédures de réticulation chimique. Après évaluation quantitative des propriétés mécaniques, ils ont examiné les applications des nanofibres Cnidoin et CPP-1 pour favoriser la croissance des cellules souches mésenchymateuses humaines.
Les nématocystes d'hydre comprennent quatre variantes qui se développent dans la colonne corporelle des polypes dans des cellules spécialisées appelées nématocytes. La résistance mécanique exceptionnelle de la structure de la paroi de la capsule rend les nématocystes uniques pour former des matériaux bioinspirés en laboratoire. La capsule contient des complexes protéiques réticulés par des ponts disulfure intermoléculaires entre des domaines riches en cystéine (CRD), qui peut être utilisé comme agent de réticulation polyvalent pour créer des polymères linéaires ou ramifiés parmi diverses protéines. Les scientifiques avaient déjà identifié deux nouvelles protéines de capsule, dont CPP-1 et Cnidoin, tout en étudiant les nématocystes d'Hydra dans leurs travaux précédents. Le potentiel de combiner la Cnidoine élastique et les protéines CPP-1 rigides était une stratégie prometteuse pour concevoir de nouveaux biomatériaux capables de former des structures stables avec une réticulation spontanée pour obtenir une flexibilité et une ténacité exceptionnelles, similaire aux capsules de nématocystes biologiques. Les nanofibres de protéines synthétiques bioinspirées ont attiré de plus en plus l'attention en tant que matrice artificielle pour la culture de cellules souches pour des applications d'ingénierie tissulaire. L'électrofilage offre une méthode courante pour fabriquer de telles fibres en utilisant des protéines de soie, collagène et gélatine. Les produits à fibres minces ont de multiples applications dans la cicatrisation des plaies et l'ingénierie tissulaire.
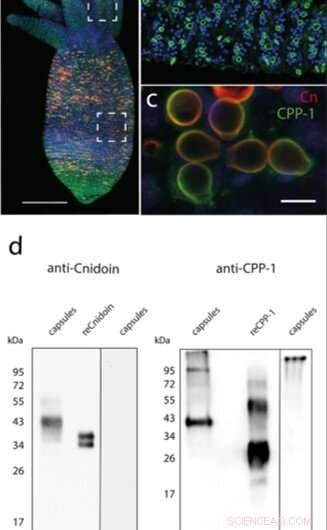
(a) Image d'immunofluorescence d'un polype Hydra coloré avec des anticorps CPP-1 et Cnidoin ; noyaux cellulaires (bleu), RPC-1 (vert), et Cnidoin (rouge). (b) Les capsules matures dans les tentacules n'ont montré que des signaux CPP-1. (c) Des images de zoom avant de capsules dans la région gastrique ont indiqué une co-localisation de CPP-1 et de Cnidoin dans les parois des nématocystes. (d) Analyse Western blot de CPP-1 et Cnidoin dans des nématocystes isolés et après expression recombinante dans E. coli (reCPP-1, reCnidoin). (+) et (-) indiquent la présence ou l'absence de -mercaptoéthanol (β-ME) dans le tampon de l'échantillon. Crédit :Rapports scientifiques, doi:10.1038/s41598-019-55655-0
Dans le travail present, Bentele et al. a introduit une nouvelle classe de nanofibres synthétiques sans réticulant basées sur les protéines nématocystes Hydra CPP-1 et Cnidoin en utilisant l'électrofilage. Sur la base de la capacité de réticulation spontanée des CRD, ils ont systématiquement optimisé les conditions de préparation pour concevoir des nanofibres de protéines sans réticulant qui sont stables sous l'eau avec des applications potentielles pour la culture de cellules souches humaines. L'équipe de recherche a obtenu des images d'immunofluorescence représentatives d'une Hydra conjuguée avec des anticorps CPP-1 (vert) et Cnidoin (rouge) pour co-localiser les protéines dans la paroi de la capsule. Les images ont indiqué la présence de Cnidoin comme plus densément emballé dans les parois des nématocystes matures par rapport à CPP-1. Après, Bentele et al. utilisé des méthodes de transfert Western pour identifier les capsules de nématocystes natifs isolés et les protéines recombinantes (protéines exprimées dans d'autres organismes); qu'ils ont produit dans E. coli. Les résultats ont indiqué des modifications post-traductionnelles considérables de CPP-1 dans Hydra. Ils ont confirmé les résultats en utilisant la protéine CPP-1 telle qu'exprimée dans E. coli et en ont déduit que la CPP-1 et la Cnidoine étaient des protéines structurelles de la paroi du nématocyste intégrées lors de la formation ou de la morphogenèse.
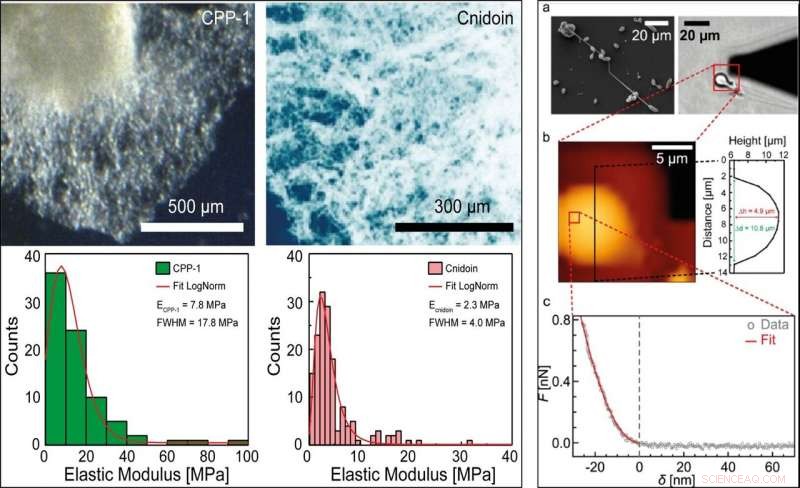
À GAUCHE :modules élastiques efficaces du CPP-1 et de la Cnidoine recombinants dans du PBS. Des agrégats de protéines reCPP-1 et reCnidoine purifiées et oxydées ont été soumis à des indentations AFM. Les distributions des modules élastiques effectifs ont été ajustées en utilisant une distribution log-normale. Les positions des pics et la FWHM sont indiquées sous forme de légendes. DROITE :(a) Gauche :image SEM d'un nématocystes partiellement déchargés. Droite :Image de microscopie à fond clair d'un sténothèle isolé déchargé. L'ombre du triangle noir correspond au porte-à-faux AFM. (b) Carte de hauteur du nématocyste déchargé collecté dans le carré rouge en (a) (17 × 17 µm2). (c) Une courbe force-indentation typique mesurée sur le nématocyste à la position indiquée par le carré rouge en (b) (1,1 × 1,1 µm2). Les données force-indentation (cercles gris) ont été ajustées avec le modèle Bilodeau pour pointes pyramidales (courbe rouge). Crédit :Rapports scientifiques, doi:10.1038/s41598-019-55655-0
Les chercheurs ont ensuite testé les propriétés mécaniques des nématocystes Hydra et des protéines en vrac à l'aide de la microscopie électronique à balayage (MEB) et de la microscopie à force atomique (AFM). Les scientifiques ont extrait la distribution des modules d'élasticité et ont en outre mesuré l'élasticité de la CPP-1 recombinante purifiée (reCPP-1) et de la Cnidoine (reCnidoin) exprimées dans E. coli. Ils ont ensuite optimisé la production de nanofibres en introduisant du polyéthylène glycol (PEG) 900 kDa dans la solution pure pour obtenir une viscosité plus élevée du produit. L'équipe a étudié l'influence de l'humidité relative, qui a considérablement affecté la qualité des nanofibres, tandis que la force ionique ou la conductivité des solutions de filage n'ont montré aucune influence sur les nanofibres.
Sur la base des résultats préliminaires de développement et de caractérisation des matériaux, Bentele et al. nanofibres de protéines fabriquées par électrofilage de la solution de protéine-PEG sur des lamelles de verre. Les nanofibres recCPP-1-PEG fraîchement filées ont montré une largeur et une hauteur uniformes sur une surface de 50 x 50 µm 2 et présente un module d'élasticité uniforme. L'équipe a ensuite mesuré la topographie de surface, obtenu une carte d'élasticité et une courbe caractéristique force-indentation pour les nanofibres reCPP-1 et reCnidoin (a) dans l'air, (b) à l'air après lavage à l'eau, et dans (c) une solution tampon physiologique. Ils pourraient éliminer le PEG par lavage à l'eau pour obtenir une épaisseur de fibre considérablement diminuée pour les nanofibres reCnidoin, bien que les dimensions soient moins prononcées par rapport au reCPP-1 après traitement de l'eau.
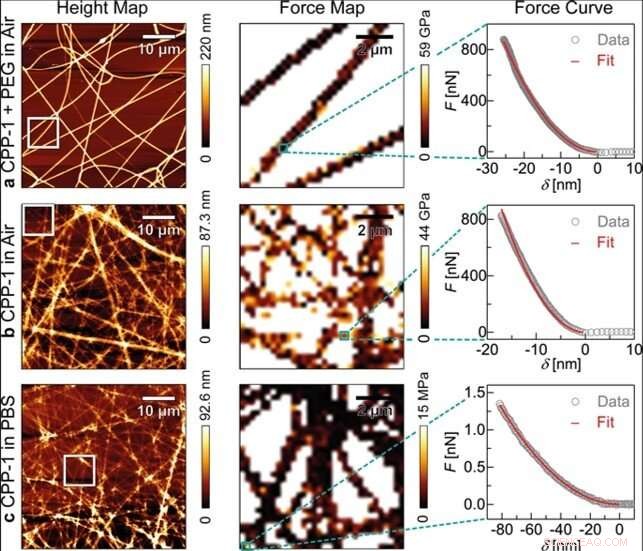
Mesures AFM des fibres électrofilées reCPP-1. D'abord, un mélange reCPP-1:PEG (1:1) a été électrofilé et caractérisé dans l'air (a). Seconde, les fibres reCPP-1:PEG ont été lavées à l'eau, et les fibres reCPP-1 restantes ont été caractérisées dans l'air (b), ainsi que dans PBS (c). Chaque jeu de données se compose de cartes de hauteur (colonne de gauche), cartes de force (colonne du milieu), et courbes caractéristiques force-enfoncement (colonne de droite) ajustées au modèle de Bilodeau (courbe rouge). Crédit :Rapports scientifiques, doi:10.1038/s41598-019-55655-0
Cependant, les fibres ne se dissolvent pas entièrement après lavage à l'eau et conservent leurs modules d'élasticité. Les résultats suggèrent que les deux protéines recombinantes peuvent établir des nanofibres stables en formant spontanément des liaisons disulfure entre les terminaisons CRD (domaine riche en cysteine). Les protéines de nématocystes d'Hydra recombinantes produites dans ce travail ont également formé des nanofibres uniformes et stables grâce à des CRD naturels dans l'air et dans un tampon physiologique. L'équipe a examiné les applications de ces nanofibres avec une culture stable de cellules souches mésenchymateuses humaines pendant 20 jours d'incubation, au cours de laquelle environ 95 pour cent des cellules ont montré une croissance cellulaire et une viabilité sur les nouveaux matériaux bioinspirés.
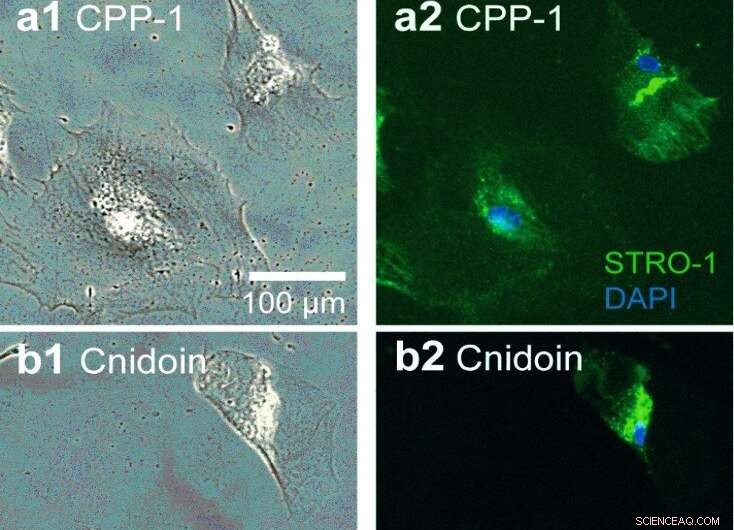
Maintenance de hMSC sur des substrats de nanofibres. Substrats de nanofibres protéiques recouverts de (a) reCPP-1 et (b) de nanofibres reCnidoin pendant 20 jours. Les images de microscopie à contraste de phase (a1 et b1) et les images de fluorescence correspondantes (a2 et b2) montrent l'expression de STRO-1 (vert) dans le cytosol de hMSC. Les noyaux cellulaires ont été colorés au DAPI (bleu). (c) Fractions de hMSC immunoréactives à l'anti STRO-1, cultivé pendant 20 j sur verre (témoin), nanofibres reCPP-1 et reCnidoin (N> 30 pour chaque échantillon). Crédit :Rapports scientifiques, doi:10.1038/s41598-019-55655-0
De cette façon, Theresa Bentele et ses collègues ont proposé un nouveau biomatériau synthétique de nanofibres sans réticulant, bio-inspiré par les protéines de la capsule des nématocystes d'Hydra. Ils ont exprimé des protéines recombinantes de deux protéines de capsule de nématocyste CPP-1 et Cnidoine récemment identifiées dans E. coli et ont préparé des nanofibres par électrofilage. En raison des domaines riches en cystéine (CRD), les fibres électrofilées pourraient se réticuler spontanément via des liaisons disulfure. Les protéines recombinantes reCPP-1 et reCnidoin ont formé des nanofibres uniformes qui étaient stables dans l'eau directement après l'électrofilage. Les nouvelles constructions de matériaux ont démontré leur potentiel en tant que matériaux biocompatibles inspirés de la structure résistante et élastique du nématocyste Hydra.
© 2019 Réseau Science X