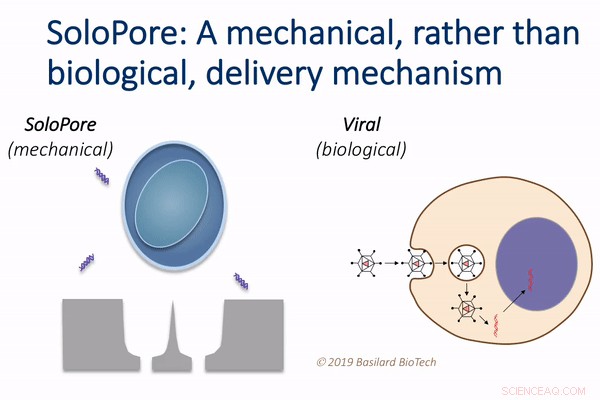
La technologie SoloPore de Basilard BioTech, par rapport à la livraison virale. Crédit :Basilard Biotech
Et si vous pouviez guérir le cancer en réorganisant les cellules des patients pour mieux cibler et détruire leurs propres tumeurs ? Avec l'avènement de nouvelles technologies puissantes d'ingénierie cellulaire, ce n'est plus de la science-fiction.
Au cours des dernières années, ces technologies ont permis le développement de thérapies cellulaires révolutionnaires pour le traitement du cancer, telles que les immunothérapies du cancer à cellules CAR-T pour la leucémie et le lymphome. Ils ont également permis le développement de traitements pour des maladies génétiques rares, telles que les thérapies géniques HSC pour la « maladie de Bubble Boy » et la bêta-thalassémie. Des chercheurs du monde entier travaillent à plein régime pour développer des thérapies similaires pour un grand nombre d'autres maladies mortelles et débilitantes.
Mais il y a un hic :avec le coût de ces soi-disant « drogues vivantes » allant de quelques centaines de milliers de dollars à près de 2 millions de dollars, on ne sait pas s'ils seront suffisamment accessibles à tous ceux qui en ont besoin.
Maintenant, dans une avance de bassin versant, ingénieurs de l'Université de Californie, Bord de rivière, en collaboration avec des chercheurs du City of Hope National Medical Center, ont inventé un dispositif qui a le potentiel de produire en masse des cellules d'ingénierie à moindre coût, un point de basculement pour ces thérapies qui sauvent des vies.
Dans un nouvel article de la revue Lettres nano , une équipe de chercheurs dirigée par Masaru Rao, professeur agrégé de génie mécanique au Marlan and Rosemary Bourns College of Engineering, décrit une nouvelle technologie de dispositif microfluidique capable de traiter l'une des étapes les plus coûteuses du processus de fabrication de la thérapie cellulaire artificielle, à savoir la livraison de gènes.
Cette technologie, que les auteurs appellent mécanoporation déterministe, ou DMP, utilise le flux de fluide pour tirer chaque cellule d'une grande population sur sa propre petite aiguille. Le flux est ensuite inversé pour libérer les cellules des aiguilles, laissant un pore singulier et précisément défini dans chaque cellule qui permet la livraison de gènes.
"Ce simple, mais une approche de poration nanomécanique élégante offre des avantages significatifs par rapport aux techniques de délivrance de gènes existantes, " dit Rao. " Par exemple, puisque les vecteurs viraux représentent une grande partie du coût de fabrication global des thérapies cellulaires actuelles, leur élimination grâce à l'utilisation du DMP offre un potentiel de réduction considérable des coûts."
Le mécanisme de poration à site unique unique de DMP est essentiel, puisqu'il minimise les dommages à la cellule, tout en produisant une voie bien définie pour l'introduction de gènes. Cela offre la possibilité d'atteindre à la fois une efficacité de livraison élevée et une viabilité cellulaire, ce qui est difficile à réaliser en utilisant d'autres techniques d'administration non virales, comme l'électroporation.
"En réalité, dans notre article, nous montrons que le DMP peut fabriquer des cellules T humaines primaires, le même type de cellules utilisées dans les thérapies CAR-T, avec des rendements qui dépassent de plus de quatre fois un outil d'électroporation de pointe, " dit Rao.
La technologie DMP a été brevetée par UC Riverside et récemment concédée sous licence à une nouvelle entreprise en démarrage que Rao a créée dans son laboratoire, Basilard BioTech. L'entreprise cherche à développer la technologie, qu'il a marqué SoloPore, en tant que nouvelle solution de rupture pour la conception de thérapies cellulaires et géniques ex vivo pour le cancer en particulier, ainsi que les troubles génétiques et les maladies dégénératives plus largement.
Le papier, "Massivement parallélisé, Mécanoporation déterministe pour la livraison intracellulaire, " est publié dans la revue, Lettres nano .