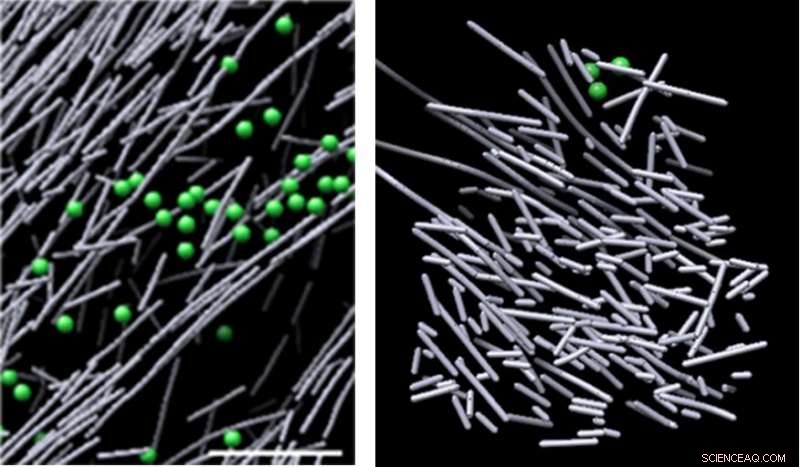
Images au microscope cryo-électronique de l'assemblage d'actine dans la cellule en l'absence de signal moléculaire (à gauche) et du nano-échafaudage de filament d'actine semblable à une botte de foin qui a été induit en réponse à un signal moléculaire (Rac1) et qui favorise le mouvement cellulaire (à droite). La structure est apparue dans des régions définies où Rac1 a été activé, et s'est rapidement dissipé lorsque la signalisation Rac1 s'est arrêtée - en aussi peu que deux minutes et demie. Crédit :Sanford Burnham Prebys Medical Discovery Institute (SBP)
Il y a de nombreuses fois où nos cellules ont besoin de bouger. Les cellules mobiles guident la formation de notre corps (développement embryonnaire). Les cellules immunitaires errent pour capturer les intrus indésirables. Et les cellules cicatrisantes (fibroblastes) migrent pour réparer les plaies. Mais tous les mouvements ne sont pas souhaitables :les tumeurs sont plus dangereuses lorsque les cellules cancéreuses acquièrent la capacité de se déplacer dans tout le corps (métastases). Certaines bactéries et certains virus peuvent exploiter la machinerie de la motilité des cellules pour envahir notre corps. Comprendre comment les cellules se déplacent - et les filaments d'actine en forme de bâtonnets qui entraînent le processus - est essentiel pour apprendre à arrêter ou à favoriser la motilité afin d'améliorer la santé humaine.
Maintenant, en utilisant l'un des microscopes les plus puissants au monde, des scientifiques du Sanford Burnham Prebys Medical Discovery Institute (SBP) et de l'Université de Caroline du Nord à Chapel Hill (UNC-Chapel Hill) ont identifié un nano-échafaudage de filaments d'actine dynamique et désorganisé, ressemblant à une botte de foin, induit en réponse à un signal moléculaire. C'est la première fois que des chercheurs visualisent directement, au niveau moléculaire, une structure qui est déclenchée en réponse à un signal cellulaire - une découverte clé qui élargit notre compréhension de la façon dont les cellules se déplacent. L'étude a été publiée dans le Actes de l'Académie nationale des sciences des États-Unis d'Amérique ( PNAS ).
"La microscopie cryoélectronique révolutionne notre compréhension du fonctionnement interne des cellules, " dit Dorit Hanein, Doctorat., auteur principal de l'article et professeur au programme de bioinformatique et de biologie structurale de la SBP. « Cette technologie nous a permis de collecter des robustes, Images 3D de régions de cellules similaires à l'IRM, qui crée des images détaillées de notre corps. Nous avons pu visualiser les cellules dans leur état naturel, qui a révélé une nano-architecture d'actine jamais vue auparavant dans la cellule."
Dans l'étude, les scientifiques ont utilisé le microscope cryoélectronique de SBP (Titan Krios), intelligence artificielle (IA) et approches de calcul et d'imagerie cellulaire sur mesure pour comparer des images nanométriques de fibroblastes de souris à des images lumineuses horodatées de Rac1, fluorescent une protéine qui régule le mouvement cellulaire, réponse à la force ou à la contrainte (mécanodétection) et invasion d'agents pathogènes. Ce flux de travail techniquement complexe, qui couvrait cinq ordres de grandeur d'échelle (des dizaines de microns aux nanomètres), a mis des années à se développer jusqu'à son niveau actuel de robustesse et de précision et a été rendu possible grâce aux efforts expérimentaux et informatiques des équipes de biologistes des structures de SBP et l'équipe de biocapteurs à l'UNC-Chapel Hill.
Les images ont révélé une densité dense, désorganisé, structure semblable à un échafaudage composée de courts bâtonnets d'actine. Ces structures sont apparues dans des régions définies où Rac1 a été activé, et s'est rapidement dissipé lorsque la signalisation Rac1 s'est arrêtée, en moins de deux minutes et demie. Cet échafaudage dynamique contrastait fortement avec divers autres assemblages d'actine dans les zones de faible activation de Rac1 - certains composés de longs, bâtonnets d'actine alignés, et d'autres composés de courts bâtonnets d'actine se ramifiant à partir des côtés de filaments d'actine plus longs. Le volume renfermant l'échafaudage d'actine était dépourvu de structures cellulaires communes, comme les ribosomes, microtubules, vésicules et plus, probablement en raison de la densité intense de la structure.
"Nous avons été surpris qu'expérience après expérience ait révélé ces points chauds uniques de non-alignés, des bâtonnets d'actine densément emballés dans des régions en corrélation avec l'activation de Rac1, " dit Niels Volkmann, Doctorat., un co-auteur de l'article qui a dirigé la partie informatique de l'étude, et professeur au programme de bioinformatique et de biologie structurale de la SBP. "Nous pensons que ce trouble est en fait la force de l'échafaudage - il offre la flexibilité et la polyvalence pour construire plus grand, architectures complexes de filaments d'actine en réponse à des indices spatiaux locaux supplémentaires."
Prochain, les scientifiques aimeraient étendre le protocole pour visualiser davantage de structures créées en réponse à d'autres signaux moléculaires et développer davantage la technologie pour permettre l'accès à d'autres régions de la cellule.
"Cette étude n'est que le début. Maintenant que nous avons développé ce flux de travail quantitatif à l'échelle nanométrique qui corrèle le comportement de signalisation dynamique avec la résolution à l'échelle nanométrique de la cryo-tomographie électronique, nous et d'autres scientifiques pouvons mettre en œuvre ce puissant outil analytique non seulement pour déchiffrer le fonctionnement interne du mouvement cellulaire, mais aussi pour élucider la dynamique de nombreuses autres machines macromoléculaires dans un environnement cellulaire non perturbé, " dit Hanein.
Elle ajoute, « L'actine est une protéine de base ; elle interagit avec plus de 150 protéines de liaison à l'actine pour générer diverses structures, chacun remplissant une fonction unique. Nous avons un surplus de différents signaux que nous aimerions cartographier, ce qui pourrait donner encore plus d'informations sur la façon dont les cellules se déplacent. »