Avec les nouveaux heptapeptides, des chercheurs de l'IBB-UAB démontrent que seuls quatre types différents d'acides aminés, distribué d'une manière spécifique et combiné toujours avec un autre cinquième type, suffisent pour obtenir le code complet nécessaire à la formation des fibres synthétiques de prions. Crédit :IBB-UAB
Des chercheurs de l'Institut de biotechnologie et de biomédecine (IBB-UAB) ont généré quatre peptides, molécules plus petites que les protéines, capable de s'auto-assembler de manière contrôlée pour former des nanomatériaux. La recherche, publié dans la revue ACS Nano , a été menée par Salvador Ventura, Marta Díaz Caballero et Susanna Navarro (IBB-UAB), et comprenait la collaboration d'Isabel Fuentes et Francesc Teixidor (Institut des sciences des matériaux de Barcelone, ICMAB-CSIC).
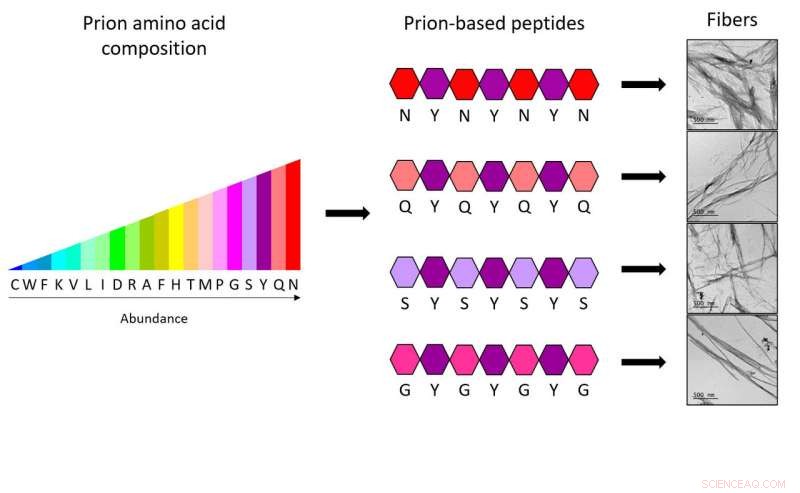
Les nouvelles molécules sont formées par une chaîne de sept acides aminés, dont chacun est composé de seulement deux acides aminés, accélérant et réduisant ainsi considérablement le coût de création de structures amyloïdes synthétiques fonctionnelles avec lesquelles générer des nanomatériaux pour la biomédecine et la nanotechnologie.
En biotechnologie, générer des structures amyloïdes synthétiques fonctionnelles pour former des nanostructures en imitant le processus de génération naturel n'est pas nouveau. L'assemblage de protéines en fibres stables permet de créer des formes supramoléculaires qu'aucune protéine isolée ne peut créer, et qui sont utilisés comme nanoconducteurs, ouvrages photovoltaïques, biocapteurs et catalyseurs.
Assez récemment, les chercheurs ont commencé à synthétiser des séquences de protéines prions pour former des nanomatériaux. L'intérêt de ces séquences réside dans le fait que les protéines s'assemblent de manière plus lente et plus contrôlée, formant très ordonné, nanostructures non toxiques. Cependant, le fait que la séquence soit si longue, avec plus de 150 acides aminés, rend la synthèse très difficile et coûteuse.
"Nous avons démontré qu'une conception adéquate peut permettre de réduire la taille des séquences de prions synthétiques à seulement 7 acides aminés, tout en conservant les mêmes propriétés. Les quatre peptides que nous avons fabriqués sont les structures les plus courtes de ce type créées jusqu'à présent, et sont capables de former des assemblages de fibrilles stables, " dit Salvador Ventura, chercheur à l'IBB et au Département de biochimie et de biologie moléculaire de l'UAB.
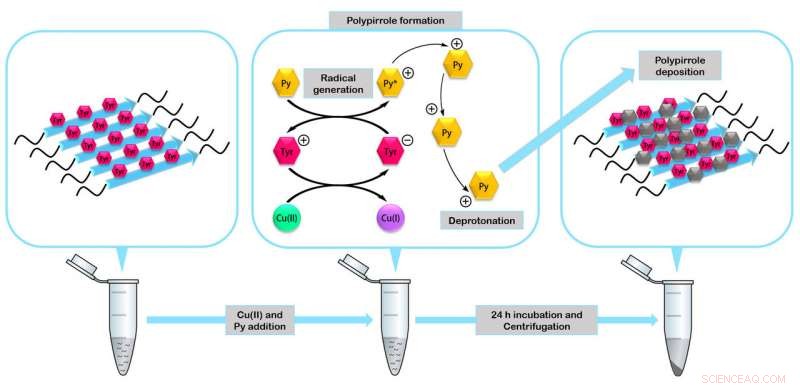
Les peptides s'assemblent pour former des enzymes miniatures capables d'agir comme catalyseurs dans la formation de nanomatériaux tels que le polymère conducteur polypyrrole. Crédit :IBB-UAB
Dans l'étude, les chercheurs ont vérifié la stabilité et la fonctionnalité des quatre peptides fabriqués. Ils ont construit l'un des nanomatériaux biologiques les plus résistants à la dégradation décrits à ce jour, des nanocâbles recouverts d'argent pouvant agir comme des nanoconducteurs électriques et des mini enzymes fibrillaires capables d'agir comme des catalyseurs dans la formation de nanomatériaux organiques.
Les nouvelles molécules ont de nombreuses applications, mais les chercheurs visent à se concentrer sur « la génération de nanoconducteurs électriques et à utiliser la connaissance de la structure amyloïde pour générer des fibres synthétiques capables d'être des catalyseurs de nouvelles réactions chimiques. L'objectif final sera de générer des matériaux hybrides peptide-inorganique capables de faire des réactions complexes, comme celles créées par les photosystèmes des plantes, " souligne le chercheur de l'IBB.
Domaines prions, au coeur de la matière
Afin de générer de nouveaux peptides, Les chercheurs de l'IBB ont basé leurs travaux sur des séquences spécifiques de protéines prions, connu sous le nom de domaines prions (PrDs). "Nous avons étudié quels acides aminés sont les plus fréquents et comment ils sont distribués dans ces régions, démontrant que seulement 4 types différents d'acides aminés répartis de manière spécifique et toujours combinés par un cinquième type d'acide aminé sont suffisants pour avoir le code complet nécessaire pour former des fibres synthétiques de prions. En réalité, chacun des heptapeptides (mini-PrDs) conçus ne contient que deux types différents d'acides aminés, " dit Salvador Ventura.
L'étude démontre la capacité d'assemblage de mini-PrD en nanostructures hautement ordonnées, un processus considéré comme impossible étant donné la forte présence d'acides aminés polaires. Les peptides résultants sont plus polaires que tout autre peptide de taille similaire utilisé jusqu'à présent pour former des amyloïdes synthétiques; cette, par exemple, leur permet de fonctionner dans les mêmes conditions que les enzymes naturelles.
Cette étude a servi à aider les chercheurs du groupe IBB Protein Folding and Conformational Diseases, dirigé par le Dr Ventura, ouvrir une nouvelle voie de recherche axée sur la conception de nanomatériaux.
"Nous n'avons jamais travaillé sur les nanotechnologies, mais en même temps nous l'avons toujours eu près de nous, car notre force réside dans la connaissance du mécanisme moléculaire d'assemblage des protéines en structures amyloïdes. Depuis longtemps, nous travaillons à la création de stratégies permettant d'éviter ce phénomène dans les maladies neurodégénératives. Ces connaissances nous ont permis de concevoir de nouvelles molécules que nous proposons désormais pour la fabrication de nouveaux nanomatériaux, " conclut le Dr Ventura.