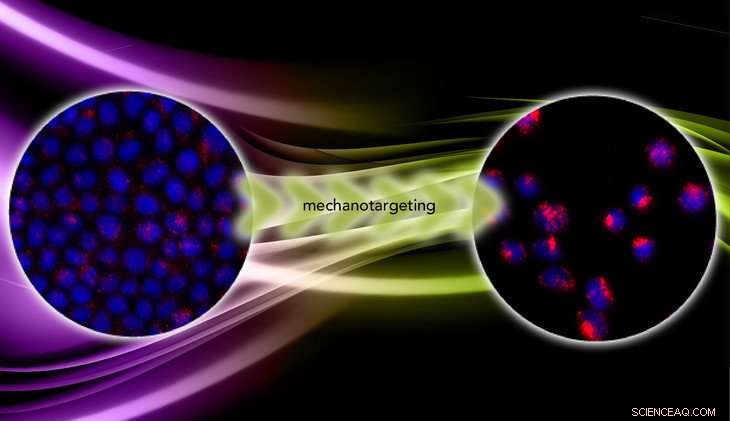
Dans la transition de bénigne à maligne, les cellules cancéreuses passent de rigides à molles. Le mécanociblage exploite la mécanique pour améliorer l'efficacité du ciblage des agents thérapeutiques à base de nanoparticules. Crédit :Zhang lab/vecteezy.com
Les bioingénieurs peuvent être en mesure d'utiliser les propriétés mécaniques uniques des cellules malades, telles que les cellules cancéreuses métastatiques, pour aider à améliorer l'administration des traitements médicamenteux aux cellules ciblées, selon une équipe de chercheurs de Penn State.
De nombreux laboratoires dans le monde développent des technologies à base de nanoparticules, systèmes d'administration de médicaments pour cibler sélectivement les tumeurs. Ils reposent sur un système de clé et de verrouillage dans lequel les clés protéiques à la surface de la nanoparticule s'enclenchent dans les verrous d'une protéine hautement exprimée à la surface de la cellule cancéreuse. La membrane cellulaire s'enroule alors autour de la nanoparticule et l'ingère. Si une quantité suffisante de nanoparticules et de leur cargaison de médicament est ingérée, la cellule cancéreuse mourra.
La force d'adhérence de la serrure et de la clé est ce qui pousse la nanoparticule dans la cellule, dit Sulin Zhang, professeur de sciences de l'ingénieur et de mécanique.
"Il est presque universel que chaque fois qu'il y a une force motrice pour un processus, il y a toujours une force de résistance, " dit Zhang. " Tiens, la force motrice est biochimique - l'interaction protéine-protéine. "
La force résistive est le coût d'énergie mécanique nécessaire pour que la membrane s'enroule autour de la nanoparticule. Jusqu'à maintenant, les bio-ingénieurs n'ont considéré que la force motrice et ont conçu des nanoparticules pour optimiser les interactions chimiques, une stratégie de ciblage appelée "chimiotargeting". Zhang pense qu'ils devraient également prendre en compte la mécanique des cellules pour concevoir des nanoparticules afin d'obtenir un ciblage amélioré, qui forme une nouvelle stratégie de ciblage appelée "mecanotargeting".
« Ces deux stratégies de ciblage sont complémentaires ; vous pouvez combiner le chimiociblage et le mécanociblage pour atteindre le plein potentiel des agents diagnostiques et thérapeutiques à base de nanoparticules, " a déclaré Zhang. " Le fait est que l'efficacité du ciblage nécessite un équilibre délicat entre les forces motrices et résistives. Par exemple, s'il y a trop de clés sur la surface des nanoparticules, même si ces clés n'interagissent que faiblement avec les verrous non correspondants sur les cellules normales, ces faibles, les interactions hors cible peuvent encore fournir suffisamment d'énergie d'adhésion pour que les nanoparticules pénètrent dans la membrane cellulaire et tuent les cellules saines. »
D'autre part, si l'énergie d'adhésion n'est pas assez élevée, la nanoparticule n'entrera pas dans la cellule.
Dans "Mechanotargeting:Mechanics-dependent Cellular Uptake of Nanoparticles, " publié en ligne avant impression dans la revue Matériaux avancés , Zhang et l'équipe rapportent les résultats d'expériences sur des cellules cancéreuses cultivées sur des hydrogels de rigidité variable. Sur les hydrogels mous, les cellules sont restées cohésives et bénignes et ont subi un stress presque constant qui a limité l'absorption des nanoparticules. Mais sur les hydrogels rigides, les cellules sont devenues métastatiques et ont adopté une forme tridimensionnelle, offrant plus de surface d'adhésion pour les nanoparticules, et est devenu moins stressé. A cette condition, les cellules ont pris cinq fois plus de nanoparticules que les cellules bénignes.
« Les nanoparticules sont fluorescentes, nous comptons donc le nombre de nanoparticules qui pénètrent dans la cellule par l'intensité de fluorescence. Nous avons constaté que dans les cellules malignes, l'intensité est cinq fois plus élevée, " a dit Zhang. " Cela prouve que le mécano-ciblage fonctionne. "