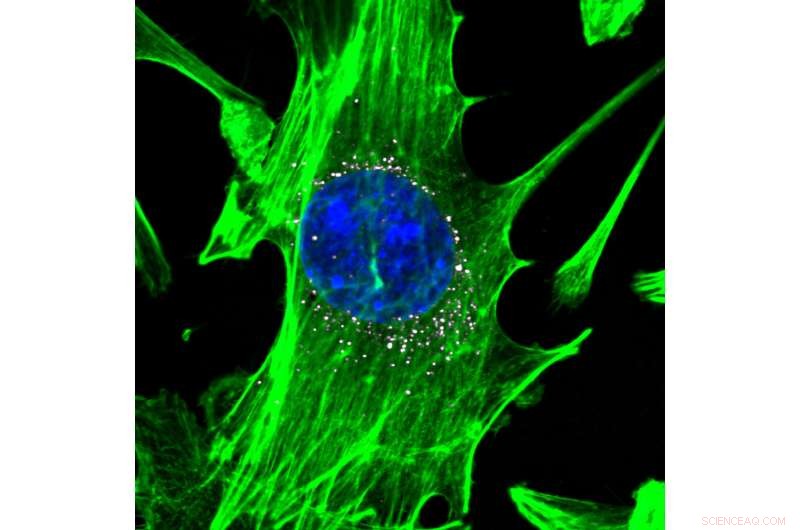
Cellules, coloré en vert avec des noyaux bleus, sont ciblés par des nanoparticules portant des codes-barres ADN (blanc). Les nanoparticules délivrent efficacement leur charge utile d'ADN dans les cellules. Crédit :Daryll A. Vanover, Kalina Paunovska, et Cory Sago à Georgia Tech
La première comparaison directe des techniques de criblage in vitro et in vivo pour identifier les nanoparticules pouvant être utilisées pour transporter des molécules thérapeutiques dans les cellules montre que les tests dans des boîtes de laboratoire ne sont pas d'une grande aide pour prédire quelles nanoparticules entreront avec succès dans les cellules d'animaux vivants.
La nouvelle étude a démontré les avantages d'une technique de codage à barres d'ADN in vivo, qui attache de petits fragments d'ADN à différentes nanoparticules lipidiques qui sont ensuite injectées dans des animaux vivants; plus d'une centaine de nanoparticules peuvent être testées sur un seul animal. Les techniques de séquençage de l'ADN sont ensuite utilisées pour identifier quelles nanoparticules pénètrent dans les cellules d'organes spécifiques, faire des particules des candidats pour transporter des thérapies géniques pour traiter des maladies mortelles telles que les maladies cardiaques, le cancer et la maladie de Parkinson.
La technique traditionnelle d'identification des nanoparticules prometteuses examine comment les particules pénètrent dans les cellules vivantes conservées dans des boîtes de laboratoire. Pour comparer les nouvelles et les anciennes techniques de dépistage, les chercheurs ont ajouté des nanoparticules à code-barres à des cellules vivantes dans des boîtes de laboratoire, et injecté des nanoparticules à code-barres identiques dans des modèles animaux vivants. Ils n'ont trouvé presque aucune corrélation entre les nanoparticules identifiées comme prometteuses dans les tests de laboratoire et celles qui ont réellement bien fonctionné chez les souris.
« Le code-barres ADN a le potentiel de faire progresser la science de la sélection de nanoparticules pour la délivrance de thérapies géniques, " dit James Dahlman, professeur adjoint au département de génie biomédical Wallace H. Coulter de Georgia Tech et Emory University et chercheur principal de l'étude. « En utilisant cette technique, les entreprises et les laboratoires universitaires pourraient sélectionner des nanoparticules prometteuses beaucoup plus efficacement. Cela pourrait accélérer la vitesse à laquelle les thérapies à base de nanoparticules entrent en clinique, tout en réduisant le nombre d'expérimentations animales nécessaires."
La recherche, qui est soutenu par les National Institutes of Health, l'Institut de recherche sur le cancer, Fondation de la fibrose kystique et Fondation de la maladie de Parkinson, a été rapporté le 28 février dans le journal Lettres nano . La recherche a été menée par des scientifiques du Georgia Institute of Technology et de l'Université Emory.

Cette image en gros plan montre une puce microfluidique utilisée pour fabriquer des nanoparticules qui pourraient être utilisées pour administrer des gènes thérapeutiques à des organes spécifiques du corps. Des liquides colorés ont été ajoutés pour mettre en valeur les canaux. Crédit :Rob Felt, Géorgie Tech
Thérapies génétiques, tels que ceux fabriqués à partir d'ADN ou d'ARN, face à des défis en raison de la difficulté à livrer l'acide nucléique aux bonnes cellules. Au cours des deux dernières décennies, les scientifiques ont développé des nanoparticules faites à partir d'un large éventail de matériaux et ont ajouté des composés tels que le cholestérol pour aider à transporter ces agents thérapeutiques dans les cellules. Mais le développement des porteurs de nanoparticules a été ralenti par les défis de les tester, premier en culture cellulaire pour identifier des nanoparticules prometteuses, et plus tard chez les animaux. Avec des millions de combinaisons possibles, l'identification des nanoparticules optimales pour cibler chaque organe a été écrasante.
L'utilisation de brins d'ADN de seulement 58 nucléotides pour identifier de manière unique chaque particule permet aux chercheurs d'ignorer complètement le dépistage de la culture cellulaire et de tester simultanément une centaine ou plus de types différents de nanoparticules sur une poignée d'animaux.
« Si vous vouliez tester 200 nanoparticules de manière traditionnelle, vous auriez besoin de 600 souris, trois pour chaque type de nanoparticule, " a déclaré Dahlman. " En utilisant la technique du codage à barres de l'ADN, que nous appelons Joint Rapid DNA Analysis of Nanoparticles (JORDAN), nous sommes capables de faire les tests sur seulement trois animaux."
L'étude a examiné l'entrée de nanoparticules dans les cellules endothéliales et les macrophages pour l'étude in vitro, et le même type de cellules du poumon, coeur et moelle osseuse pour la composante in vivo. Les deux types de cellules sont importants pour un large éventail de systèmes d'organes dans le corps et jouent un rôle actif dans des maladies qui pourraient être des cibles pour les thérapies par acides nucléiques. L'étude a comparé la façon dont les mêmes 281 nanoparticules lipidiques livraient les codes-barres dans des plats de laboratoire et des animaux vivants.
"Il n'y avait aucune capacité prédictive entre les tests de laboratoire et les tests sur les animaux, " a déclaré Dahlman. " Si les tests in vitro avaient été de bons prédicteurs, alors les particules qui ont bien fonctionné dans le plat auraient également bien fait dans les animaux, et les particules qui ont mal fonctionné dans le plat auraient également mal fonctionné chez les animaux. On ne l'a pas vu du tout."

James Dahlman, professeur adjoint au département de génie biomédical Wallace H. Coulter de Georgia Tech et Emory University, détient une puce microfluidique utilisée pour fabriquer des nanoparticules qui pourraient être utilisées pour délivrer des gènes thérapeutiques. Crédit :Rob Felt, Géorgie Tech
L'équipe de recherche, dirigé par les co-premiers auteurs Kalina Paunovska et Cory D. Sago, ont également étudié comment la livraison de nanoparticules change avec le microenvironnement de types de tissus spécifiques. Pour ça, ils ont quantifié comment 85 nanoparticules ont délivré des codes-barres d'ADN à huit populations cellulaires dans la rate, et a découvert que les types cellulaires dérivés de progéniteurs myéloïdes avaient tendance à être ciblés par des nanoparticules similaires.
Les chercheurs s'intéressent non seulement aux nanoparticules qui délivrent les traitements les plus efficaces, mais aussi qui peuvent les délivrer sélectivement à des organes spécifiques. Thérapeutique ciblée sur les tumeurs, par exemple, doit être administré uniquement à la tumeur et non aux tissus environnants. Les produits thérapeutiques pour les maladies cardiaques devraient également s'accumuler sélectivement dans le cœur.
Les séquences de code-barres d'ADN simple brin utilisées dans la technique ont à peu près la même taille que les oligonucléotides antisens, microARN et siARN en cours de développement pour d'éventuelles utilisations thérapeutiques. D'autres thérapies génétiques sont plus larges, et des recherches supplémentaires seraient nécessaires pour déterminer si la technique pourrait être utilisée avec eux.
Une fois les nanoparticules prometteuses identifiées par le criblage, ils seraient soumis à des tests supplémentaires pour vérifier leur capacité à administrer des traitements. Pour éviter la possibilité de fusion de nanoparticules, seules les structures stables en milieu aqueux peuvent être testées avec cette technique. Seules les nanoparticules non toxiques peuvent être criblées, et les chercheurs doivent contrôler l'inflammation potentielle générée par l'ADN inséré.
« Les thérapies à base d'acides nucléiques sont très prometteuses pour traiter une gamme de maladies graves, " a déclaré Dahlman. " Nous espérons que cette technique sera largement utilisée sur le terrain, et que cela apportera en fin de compte plus de clarté sur la façon dont ces médicaments affectent les cellules et comment nous pouvons les amener aux bons endroits dans le corps. »