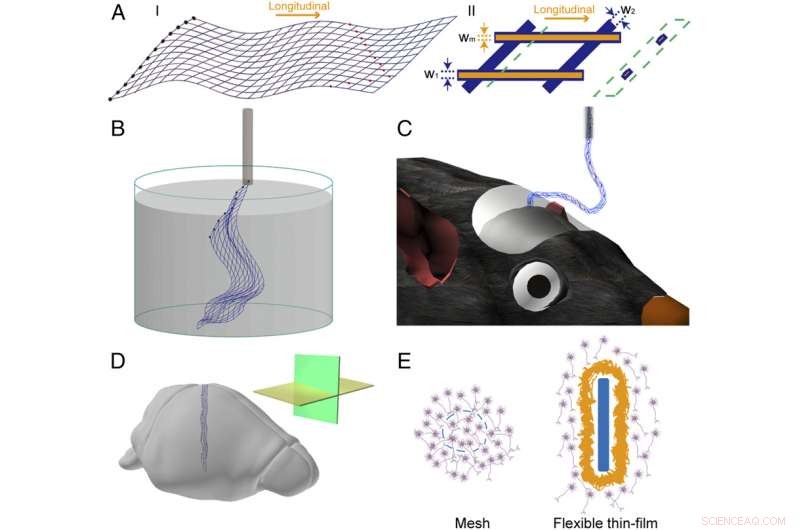
Fig. 1. Schémas de l'électronique maillée. ( UNE ) Schémas de la structure électronique maillée en 2D. ( je ) Conception globale de la structure électronique maillée, où les lignes bleues mettent en évidence la structure globale du maillage, les cercles noirs remplis à gauche indiquent les plots d'E/S, et les cercles remplis de rouge indiquent des électrodes d'enregistrement. ( II ) Une seule cellule unitaire d'électronique maillée, où les lignes oranges, qui sont représentés sans couche supérieure de polymère, mettre en évidence les interconnexions métalliques et les lignes bleues correspondent à la couche de passivation polymère ; w
(Phys.org)—Neuroprothèses, les sondes neurales et autres implants de tissus intraneuraux ont offert des avantages remarquables aux receveurs dans un certain nombre de domaines de la recherche en neurosciences et des applications biomédicales, exemples thérapeutiques étant non seulement la maladie d'Alzheimer, La maladie de Parkinson, épilepsie, lésion cérébrale traumatique, et d'autres affections neurologiques / neurologiques, ainsi que la cognition, Mémoire, et les troubles sensorimoteurs. Cependant, les implants neuronaux actuels présentent plusieurs inconvénients, y compris l'inflammation du tissu neural ou la cicatrisation due au micromouvement de l'appareil, ainsi que la longévité et le besoin potentiel d'enlèvement, et des exigences de puissance élevées. Concevoir des sondes électriques qui s'intègrent de manière transparente dans le tissu neural a donc été un objectif convoité. À cette fin, des scientifiques de l'Université Harvard ont rapporté l'implantation réussie d'un neuromorphe (c'est-à-dire, ayant une structure similaire au tissu cérébral) sonde neuronale électronique à mailles ouvertes ultraflexible qui est délivrée à des régions spécifiques du cerveau via une injection à la seringue (un protocole qu'ils ont publié en 2015 dans Nature Nanotechnologie ) 1 .
La sonde - qui ne nécessite pas d'alimentation électrique - enregistre directement les changements de tension neuronale en étant capable de s'interfacer avec toutes les régions du cerveau du niveau d'un seul neurone à travers des circuits et des réseaux, dans lequel l'électrode d'enregistrement à mailles est connectée par des lignes métalliques passivées (c'est-à-dire, ayant un revêtement protecteur appliqué sur sa surface) aux plots d'entrée/sortie situés à l'extrémité opposée de la structure en maille. Ces plots d'E/S, à son tour, sont ensuite connectés à des câbles plats flexibles (FFC) et branchés sur un système externe pour l'enregistrement. Les chercheurs ont également mené des études post-implantation systématiques, trouver des réponses immunitaires neuronales minimales ou absentes, et de plus, ce tissu cérébral avait pénétré et fusionné avec la sonde à mailles. Les scientifiques notent que l'implant en maille peut ne jamais nécessiter de retrait, mais si c'est le cas, ce serait une procédure simple, voire sans problème. Ils concluent que la plupart des domaines de la recherche fondamentale en neurosciences pourraient bénéficier de l'électronique maillée offrant une stabilité à long terme et une résolution à un seul neurone - des capacités uniques que l'on ne trouve pas dans les neuroprothèses conventionnelles - et déclarent dans leur article que les sondes électroniques à maillage ouvert ultraflexibles pourraient à l'avenir permettre un large éventail d'opportunités pour in vivo enregistrement chronique et modulation de l'activité cérébrale.
Biologie chimique Mark Hyman Jr. Professeur de chimie Charles Lieber a discuté de l'article qu'il, Auteur principal, étudiant diplômé Tao Zhou, Chercheur postdoctoral Guosong Hong, et leurs collègues publiés dans Actes de l'Académie nationale des sciences . « Le principal défi de la conception et de l'implantation d'une sonde injectable ultraflexible à mailles ouvertes est de s'assurer que la conception a quatre caractéristiques clés, " Lieber raconte Phys.org . Ces facteurs sont des ouvertures de mailles plus grandes que les corps cellulaires pour faciliter la pénétration des neurones; éléments de maillage qui sont de la même taille ou plus petits que les neurones ; flexibilité qui, dans cette étude, était de plusieurs ordres de grandeur supérieure à celle des neurones; et l'électronique de maillage qui peut être facilement injectée à travers des aiguilles de très gros calibre pour contrôler avec précision la position du maillage. "En concevant l'électronique du maillage de telle sorte que toutes les propriétés clés soient similaires sur le plan neuromorphique au tissu neural, nous éliminons la réponse immunitaire chronique que l'on retrouve avec toutes les autres sondes et implants médicaux, qui ressemblent plus à des épines dans votre tissu."
Comme mentionné précédemment, l'article des scientifiques de 2015 a lancé le concept d'électronique injectable par seringue, qui, note Lieber, ouvre un nouveau domaine avec de nombreuses opportunités en attente d'études supplémentaires, par exemple la co-injection d'électronique et de cellules où l'électronique en maille fonctionne également comme un échafaudage de croissance tissulaire pertinent pour la médecine régénérative. "Dans l'article discuté ici, nous rapportons des études histologiques chroniques systématiques en fonction du temps de l'interface tissu-maille après l'implantation des sondes à mailles dans le cerveau des rongeurs. À la fois horizontale (qui contient des coupes transversales de sondes à mailles implantées) et sagittale (qui contient presque toutes les sondes à mailles implantées) des tranches de cerveau ont été utilisées pour l'immunohistochimie et ont été colorées avec des anticorps qui peuvent cibler les soma neurones, axones, astrocytes et microglies. Les résultats de cet article révèlent le caractère unique des sondes à mailles en termes de réponse tissulaire minimale ou d'absence de réponse tissulaire et de pénétration des neurones lorsqu'elles sont implantées de manière chronique dans le cerveau.
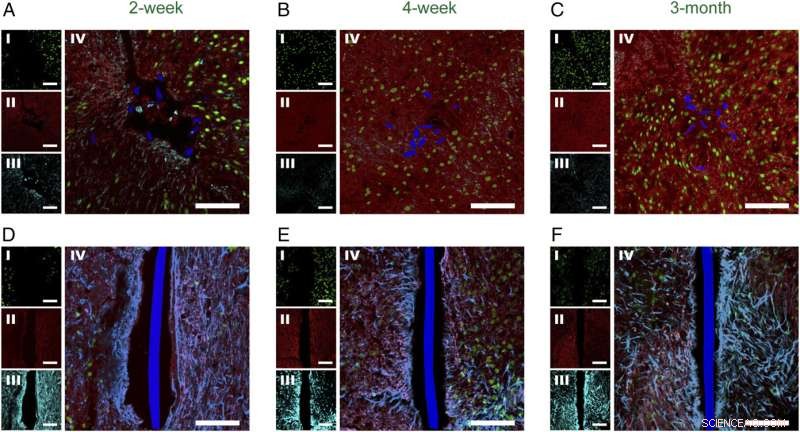
Figure 2. Histologie en fonction du temps de tranches de tissu horizontales contenant de l'électronique maillée implantée et des sondes flexibles à couche mince. Images de microscopie confocale à fluorescence de tranches de tissu horizontales contenant des sondes électroniques à mailles/à couche mince flexibles à 2 semaines ( UNE et ré ), 4 semaines ( B et E ), et 3 mois ( C et F ) post-implantation. Dans tous les panneaux, les étiquettes d'image étaient NeuN ( je , vert), NF ( II , rouge), GFAP ( III , cyan), et NeuN, NF, Composite GFAP ( IV ). L'électronique du maillage et les sections transversales flexibles des films minces sont de couleur bleue pseudo. (Barres d'échelle dans toutes les images, 100 m.) Crédit : Zhou T, Hong G, Fu T-M, Yang X, Schuhmann TG, Robert D. Viveros, DR, Lieber CM (2017) L'électronique maillée injectable par seringue s'intègre parfaitement à une réponse immunitaire chronique minimale dans le cerveau. Proc Natl Acad Sci États-Unis 114(23):5894-5899.
Les chercheurs ont utilisé la photolithographie standard pour fabriquer les sondes électroniques à mailles à l'aide d'une résine photosensible à base de polyimide (les polyimides sont biocompatibles) dans une structure à trois couches;
1. la structure du maillage inférieur (généralement ~ 400 nm d'épaisseur) est définie par la conception spécifique
2. les interconnexions métalliques, pads d'entrée/sortie, et les électrodes cérébrales sont définies, ceux-ci étant d'environ 100 nm d'épaisseur
3. la couche supérieure de résine polyimide est définie de telle sorte que tout le métal est encapsulé à l'exception des plots d'E/S et des électrodes, où l'approche et le traitement ultérieur des polymères conduisent à une structure quasi-monolithique robuste <1 um d'épaisseur
Lieber souligne que la nature neuromorphique des sondes électroniques maillées est liée aux trois points ci-dessus, la compatibilité bio/neurale du polymère polyimide utilisé pour le maillage, et la structure maillée tridimensionnelle ouverte post-implantation. Ensemble, il ajoute, ces caractéristiques rendent l'électronique maillée injectée assez similaire aux réseaux de neurones qui comprennent le tissu cérébral, et donc tout à fait distincte des sondes conventionnelles.
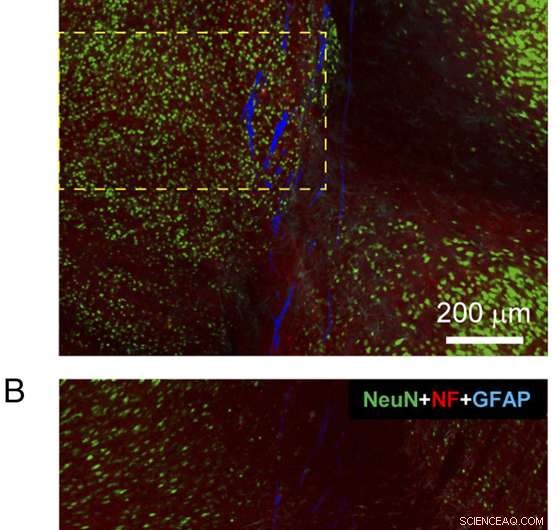
Figure 4. Histologie d'une tranche de tissu sagittal contenant la quasi-totalité de la sonde électronique à mailles implantée. ( UNE et B ) Images de microscopie confocale à fluorescence d'une tranche de tissu sagittal comprenant la sonde électronique à mailles à 3 mois après l'implantation. Chacune des images sont des images composites 3×3 enregistrées directement en mode Tile Scan, où chaque image composante du Tile Scan avait un champ de vision de 425 m × 425 μm. La tranche de tissu a été colorée avec des anticorps pour NeuN (vert), NF (rouge), et GFAP (cyan); le maillage est représenté en bleu pseudocoloré. Les images ont été enregistrées à un plan focal optique ca. 5 m sous les surfaces du côté A ( UNE ) et face B ( B ). ( C ) Intensité de fluorescence en fonction de la distance à la frontière de l'électronique du maillage dans les images de côté A ( UNE ) et face B ( B ). Les régions ombrées en rose indiquent l'intérieur de l'électronique maillée de chaque côté. L'intensité de fluorescence NF et GFAP a été analysée sur la base des images entières, et l'intensité de fluorescence NeuN a été analysée sur la base des régions indiquées dans les cases en pointillés jaunes dans UNE et B . Les barres d'erreur représentent SEM. Crédit :Zhou T, Hong G, Fu T-M, Yang X, Schuhmann TG, Robert D. Viveros, DR, Lieber CM (2017) L'électronique maillée injectable par seringue s'intègre parfaitement à une réponse immunitaire chronique minimale dans le cerveau. Proc Natl Acad Sci États-Unis 114(23):5894-5899.
« Le principal défi de démontrer que les sondes ne provoquent pas d'inflammation ou de cicatrices, contrairement à la réponse tissulaire chronique typique, est de caractériser l'interface tissu-maille à différents moments après l'implantation, " explique Lieber. Pour ce faire, sans retirer les sondes à mailles implantées, les chercheurs ont sectionné des cerveaux de souris en tranches transversales et longitudinales ou sagittales (gauche/droite). "Les études des sections transversales et longitudinales avec la sonde électronique à mailles implantée ont fourni des vues détaillées et globales, respectivement, d'interaction sonde/tissu, " note-t-il, soulignant que dans la plupart des cas, les sondes conventionnelles doivent être retirées du tissu avant la section, entraînant la perte de certaines informations d'interface critiques.
« Les tranches de cerveau horizontales et sagittales, qui contiennent des coupes transversales de sondes à mailles implantées, et la quasi-totalité de la sonde maillée implantée, respectivement - ont été colorés avec des anticorps qui peuvent cibler les soma neurones, axones, astrocytes et microglies, " Lieber continue, De plus, il souligne que ces études ont démontré que contrairement aux sondes conventionnelles, les soma neurones et les axones autour des sondes maillées n'ont pas été endommagés, et conduit à des niveaux de tissus naturels à la surface de la sonde à mailles. "De la même manière, les marqueurs de l'inflammation de la réponse immunitaire mettant en évidence les astrocytes et la microglie ont montré que ces espèces sont devenues un niveau de fond après seulement quelques semaines dans l'électronique du maillage, mais elles ont proliféré et s'accumulent aux interfaces des sondes conventionnelles. » Les scientifiques ont également découvert que la capacité de permettre les neurones et le maillage à interpénétrer sont universels pour tous les maillages injectés et imagés 6 à 12 semaines après l'injection, les incitant à lancer des expériences supplémentaires pour découvrir comment la taille des éléments structurels de l'électronique du maillage et d'autres paramètres pourraient être ajustés pour améliorer la capacité d'interpénétration des neurones.
Ça devrait être noté, Lieber raconte Phys.org , que les chercheurs sont prudents lorsqu'ils écrivent dans leur article une réponse immunitaire minimale en attendant des analyses de marqueurs plus détaillées. "En réalité, nous pensons qu'il n'y a pas de réponse immunitaire du maillage car nos résultats montrent que toute amélioration initiale des astrocytes et des microglies revient au fond sans différence mesurable à proximité ou en aval de la sonde à 12 semaines - et, comme le montre notre 2016 Méthodes naturelles papier 1 —jusqu'à au moins un an. Nous pensons donc que la réponse est due à des dommages aigus qui se produisent lors de l'insertion de l'aiguille (ou d'ailleurs, n'importe quelle sonde) dans le cerveau, mais étant donné l'absence de réponse immunitaire de la sonde à mailles, ces dommages aigus guérissent tous avec le temps, au lieu de s'aggraver, comme c'est le cas avec les sondes conventionnelles."
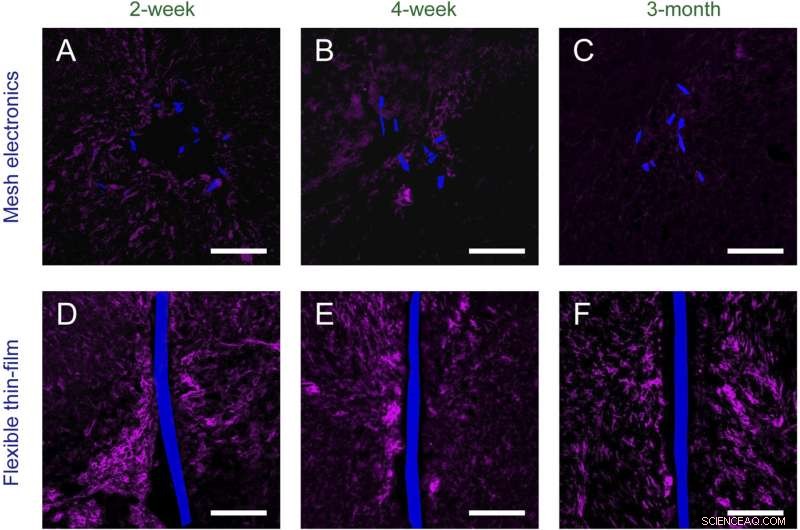
Figure S2. Histologie dépendante du temps de l'électronique maillée implantée de façon chronique ( UNE – C ) et des sondes souples à couche mince ( ré – F ) dans des cerveaux de souris (coupes horizontales). Les tranches de tissus sont marquées avec Iba-1 (magenta) pour mettre en évidence la microglie ; l'électronique maillée et les sondes à couche mince flexibles ont été imagées par DIC et sont pseudocolorées en bleu. (Barres d'échelle dans toutes les images, 100 m.) Crédit : Zhou T, Hong G, Fu T-M, Yang X, Schuhmann TG, Robert D. Viveros, DR, Lieber CM (2017) L'électronique maillée injectable par seringue s'intègre parfaitement à une réponse immunitaire chronique minimale dans le cerveau. Proc Natl Acad Sci États-Unis 114(23):5894-5899.
Le minime, les dommages aigus récupérables et l'absence de réponse immunitaire soutiennent la possibilité que l'électronique maillée puisse être viable en permanence. « D'après nos études passées et en cours à ce jour, les sondes à mailles peuvent maintenir une interface d'enregistrement/stimulation stable avec le tissu cérébral pendant au moins un à deux ans, " dit Lieber. " Cependant, cette période ne représente pas l'espérance de vie réalisable puisque des études en cours sont actuellement en cours pour démontrer une stabilité à plus long terme. les scientifiques s'attendent à trouver une stabilité plus étendue chez les mammifères à longue durée de vie tels que les macaques rhésus et dans les études actuellement en cours. "En cas d'absence de réponse immunitaire, comme le démontre notre récent article, l'espérance de vie de l'électronique maillée ne doit être déterminée que par la biocompatibilité et la durée de vie des matériaux, y compris les électrodes métalliques (or et platine, qui sont tous deux inertes), et le polymère de passivation qui a été largement étudié dans des publications précédentes (comme Nemani et al 2 ) pour montrer une stabilité à long terme dans des conditions physiologiques). Par conséquent, nous restons convaincus que l'électronique maillée aura probablement une espérance de vie avec une interface neuronale stable et des fonctions d'enregistrement/stimulation pendant des années, et envisagez le treillis en fin de compte comme un implant à vie."
Cependant, Lieber ajoute, si le grillage doit être retiré, il peut être extrait directement avec un minimum de force et de dommages au cerveau. "Bien que cela puisse causer une petite quantité de dommages en raison de l'intégration transparente avec le tissu neural, nous pensons que la stabilité sans précédent et l'absence de réponse immunitaire chronique de notre électronique à mailles de type tissu neural conduiront à un changement de paradigme où la sonde est une implantation à vie qui ne nécessite pas de retrait. »
Avancer, Lieber dit qu'ils mènent des études en cours sur de nouvelles conceptions de mailles comportant un grand nombre d'électrodes et d'injections multisites. "De plus, nos prochaines étapes comprennent l'implantation d'électronique maillée dans des tissus et des organes autres que le cerveau, par exemple, dans l'oeil pour in vivo enregistrement de cellules ganglionnaires rétiniennes uniques, dans la moelle épinière, dans le muscle pour étudier la propagation du signal à la jonction neuromusculaire, etc. Nous commençons également des études exploitant la stabilité et l'absence de réponse immunitaire chronique sans précédent de l'électronique maillée dans les modèles de la maladie d'Alzheimer et de la maladie de Parkinson, et travaillent sur l'implantation d'électronique maillée chez des sujets primates non humains et des patients humains."
Ils voient également un large éventail d'applications actuelles et potentielles bénéficier de l'utilisation de leur sonde à mailles, y compris les implants de la moelle épinière et de la jonction neuromusculaire, interfaces cerveau-machine, animaux cyborgs, vieillissement naturel et pathologique (comme la maladie d'Alzheimer) avec un aperçu de l'évolution de la mémoire spatiale et de l'apprentissage en fonction de l'âge et du stade de la maladie. De plus, en ajoutant des électrodes de stimulation, être capable de permettre une rétroaction de niveau fin qui peut améliorer ou surmonter les déclins cognitifs associés au vieillissement et à d'autres maladies neurodégénératives.
Quant aux autres domaines de recherche qui pourraient bénéficier de leur étude, Lieber dit qu'en général, la plupart des domaines de la recherche fondamentale en neurosciences pourraient bénéficier des capacités uniques de stabilité à long terme et de résolution d'un seul neurone de l'électronique maillée. "En outre, presque toutes les applications cliniques/médicales impliquant des enregistrements et/ou des stimulations électriques bénéficieront de nos études. En plus de celui mentionné ci-dessus, " conclut-il, "the mesh electronics should provide unique opportunities for brain-machine interfaces for tetraplegic patients, deep brain stimulations for the treatment of Parkinson's disease, and neural prosthetics in general."
© 2017 Phys.org