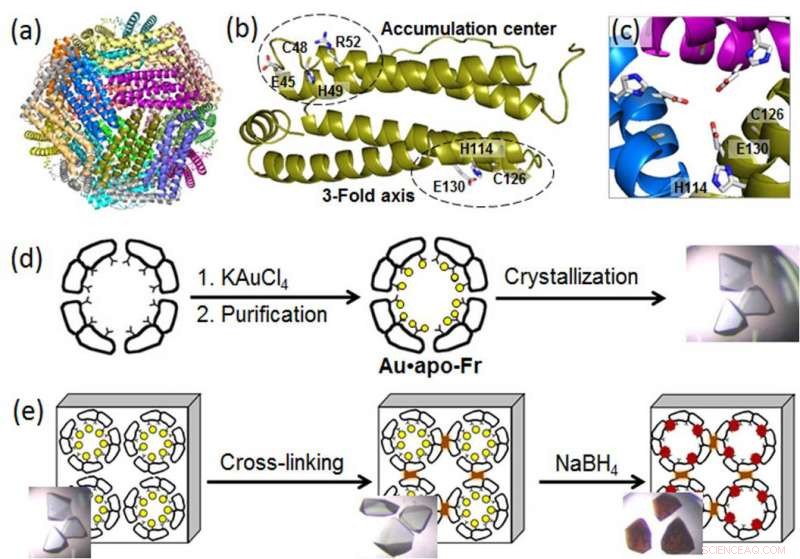
(a) Structure de la molécule de ferritine 24-mer; (b) un monomère de ferritine avec les sites de liaison aux métaux; (c) un canal à axe triple symétrique; (d) préparation et cristallisation de ferritine contenant Au; (e) réticulation du cristal de ferritine et réduction des ions Au (cercles jaunes) en atomes Au(0) qui forment des nanoclusters (particules brunes). Crédit : Institut de technologie de Tokyo
Des scientifiques de l'Institut de technologie de Tokyo ont utilisé la cristallographie à haute résolution pour découvrir le mécanisme derrière la synthèse assistée par protéines de nanoparticules d'or, fournir une plate-forme pour la conception de nanomatériaux adaptés aux applications biomédicales.
Dans les organismes vivants, les ions métalliques libres sont stockés et transportés à travers des protéines assemblées dans des structures hautement ordonnées telles que des cages protéiques via une réaction appelée biominéralisation. Cette stratégie biologique sophistiquée a attiré l'attention des biotechnologues qui spéculent que les cages protéiques naturelles de stockage d'ions peuvent être utilisées pour faire croître des nanoparticules métalliques avec les propriétés souhaitées.
Les nanoparticules d'or (AuNPs) sont connues pour leurs excellentes fonctions en catalyse, bio-imagerie, l'administration de médicaments, et thérapie; donc, la synthèse d'AuPs avec des tailles et des formes contrôlées est très importante pour leur application en nanomédecine. Dans les échafaudages protéiques, Les AuNP sont formés par un processus séquentiel impliquant le dépôt d'or et l'agglomération en petits nanoclusters qui agissent comme des centres de nucléation pour la croissance des AuNP. Cependant, le mécanisme dynamique sous-jacent à la formation de nanoclusters d'or dans les environnements protéiques reste incertain.
Pour divulguer les processus moléculaires derrière la croissance AuNP dans les nanocages de protéines, un groupe d'ingénieurs biomoléculaires de l'Institut de technologie de Tokyo, dirigé par Takafumi Ueno, utilisé la cristallographie à haute résolution et analysé la formation de nanoclusters d'or dans la ferritine. Protéine universelle de stockage du fer intracellulaire produite par presque tous les organismes vivants, la ferritine forme une nanocage de 24 sous-unités auto-assemblée avec deux sites spécifiques de liaison aux métaux :le canal à axe triple et le centre d'accumulation (Figure). Étant donné que les ions d'or ont une grande affinité pour le soufre, les scientifiques ont modifié le centre d'accumulation en introduisant un résidu de cystéine contenant du soufre supplémentaire pour améliorer l'absorption d'or dans la cage protéique. Puis, ils ont renforcé les cristaux de ferritine contenant de l'Au par réticulation dans du glutaraldéhyde (figure) pour maintenir leur structure en réseau. Ces modifications ont permis la réduction des ions or dans les cristaux et la détermination des positions de liaison des ions or à l'intérieur de la cage de ferritine par cristallographie à haute résolution.
A l'étape suivante, les ions d'or immobilisés ont été réduits en atomes Au(0) à l'aide d'un agent réducteur (NaBH4). Par conséquent, les scientifiques ont pu observer que l'or réduit s'est aggloméré en nanoclusters formé dans les canaux symétriques 3 fois et dans les centres d'accumulation de métal, ce qui était dû au mouvement progressif de l'or et aux changements de conformation des acides aminés environnants.
Les résultats obtenus par le professeur Ueno et ses collègues découvrent le mécanisme derrière la formation de nanoclusters d'or qui sont attendus comme centres de nucléation pour la croissance ultérieure d'AuNP dans l'environnement protéique unique, fournir une plate-forme pour de futures recherches sur la biominéralisation et la synthèse de nanoparticules dans les échafaudages biomoléculaires.