Une équipe du MIT a fait une découverte inattendue sur l'eau :à l'intérieur du plus petit des espaces - dans des nanotubes de carbone dont les dimensions internes ne sont pas beaucoup plus grandes que quelques molécules d'eau - l'eau peut geler solidement même à des températures élevées qui la mettraient normalement en ébullition. La découverte pourrait conduire à de nouvelles applications telles que les fils remplis de glace. Crédit :Avec l'aimable autorisation des chercheurs
C'est un fait bien connu que l'eau, au niveau de la mer, commence à bouillir à une température de 212 degrés Fahrenheit, ou 100 degrés Celsius. Et les scientifiques ont longtemps observé que lorsque l'eau est confinée dans de très petits espaces, ses points d'ébullition et de congélation peuvent changer un peu, chute généralement d'environ 10 ° C ou plus.
Mais maintenant, une équipe du MIT a découvert un ensemble de changements complètement inattendu :à l'intérieur du plus petit des espaces - dans des nanotubes de carbone dont les dimensions internes ne sont pas beaucoup plus grandes que quelques molécules d'eau - l'eau peut geler solidement même à des températures élevées qui la mettraient normalement en ébullition.
La découverte illustre comment même des matériaux très familiers peuvent changer radicalement leur comportement lorsqu'ils sont piégés à l'intérieur de structures mesurées en nanomètres, ou des milliardièmes de mètre. Et la découverte pourrait conduire à de nouvelles applications, telles que, essentiellement, fils remplis de glace—qui tirent parti des propriétés électriques et thermiques uniques de la glace tout en restant stables à température ambiante.
Les résultats sont publiés aujourd'hui dans le journal Nature Nanotechnologie , dans un article de Michael Strano, le professeur Carbon P. Dubbs en génie chimique au MIT; post-doctorant Kumar Agrawal; et trois autres.
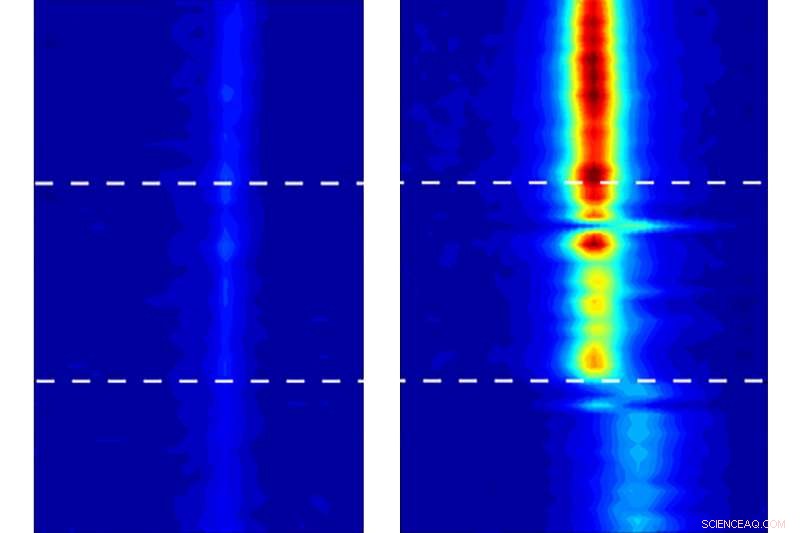
"Si vous confinez un fluide dans une nanocavité, vous pouvez en fait déformer son comportement de phase, " Strano dit, se référant à comment et quand la substance change entre solide, liquide, et phases gazeuses. De tels effets étaient attendus, mais l'énorme ampleur du changement, et sa direction (hausser plutôt que baisser le point de congélation), ont été une surprise totale :dans l'un des tests de l'équipe, l'eau s'est solidifiée à une température de 105 C ou plus. (La température exacte est difficile à déterminer, mais 105 C a été considéré comme la valeur minimale dans ce test; la température réelle aurait pu être aussi élevée que 151 C.)
"L'effet est beaucoup plus grand que quiconque ne l'avait prévu, " dit Strano.
Il s'avère que la façon dont le comportement de l'eau change à l'intérieur des minuscules nanotubes de carbone - structure la forme d'une paille de soude, entièrement composé d'atomes de carbone mais de quelques nanomètres de diamètre seulement, dépend de manière cruciale du diamètre exact des tubes. "Ce sont vraiment les plus petits tuyaux auxquels vous pourriez penser, " dit Strano. Dans les expériences, les nanotubes ont été laissés ouverts aux deux extrémités, avec des réservoirs d'eau à chaque ouverture.
Même la différence entre les nanotubes de 1,05 nanomètres et 1,06 nanomètres à travers fait une différence de dizaines de degrés dans le point de congélation apparent, les chercheurs ont trouvé. Ces différences extrêmes étaient complètement inattendues. "Tous les paris sont ouverts quand vous devenez vraiment petit, " dit Strano. "C'est vraiment un espace inexploré."
Dans les efforts antérieurs pour comprendre comment l'eau et d'autres fluides se comporteraient lorsqu'ils étaient confinés dans de si petits espaces, "il y a eu des simulations qui ont montré des résultats vraiment contradictoires, " dit-il. Cela s'explique en partie par le fait que de nombreuses équipes n'ont pas pu mesurer les tailles exactes de leurs nanotubes de carbone avec une telle précision, ne réalisant pas que de si petites différences pouvaient produire des résultats si différents.
En réalité, il est surprenant que l'eau pénètre même dans ces minuscules tubes en premier lieu, Strano dit :On pense que les nanotubes de carbone sont hydrophobes, ou hydrofuge, les molécules d'eau devraient donc avoir du mal à pénétrer à l'intérieur. Le fait qu'ils y entrent reste un peu mystérieux, il dit.
Strano et son équipe ont utilisé des systèmes d'imagerie hautement sensibles, en utilisant une technique appelée spectroscopie vibrationnelle, qui pourrait suivre le mouvement de l'eau à l'intérieur des nanotubes, soumettant ainsi son comportement à une mesure détaillée pour la première fois.
L'équipe peut détecter non seulement la présence d'eau dans le tube, mais aussi sa phase, il dit :"On peut dire si c'est de la vapeur ou du liquide, et nous pouvons dire si c'est dans une phase rigide." Alors que l'eau entre définitivement dans une phase solide, l'équipe évite de l'appeler "glace" car ce terme implique un certain type de structure cristalline, dont ils n'ont pas encore pu montrer de façon concluante l'existence dans ces espaces confinés. "Ce n'est pas forcément de la glace, mais c'est une phase de glace, " dit Strano.
Parce que cette eau solide ne fond que bien au-dessus du point d'ébullition normal de l'eau, il doit rester parfaitement stable indéfiniment dans des conditions de température ambiante. Cela en fait potentiellement un matériau utile pour une variété d'applications possibles, il dit. Par exemple, il devrait être possible de faire des "fils de glace" qui seraient parmi les meilleurs porteurs connus pour les protons, parce que l'eau conduit les protons au moins 10 fois plus facilement que les matériaux conducteurs typiques. "Cela nous donne des fils d'eau très stables, à température ambiante, " il dit.