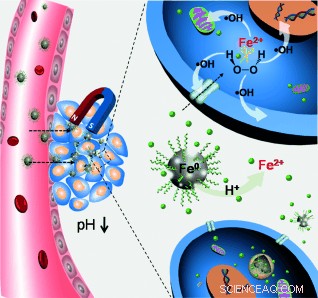
Les nanoparticules de fer amorphe ont une toxicité spécifique dans les cellules tumorales. Dans la revue Angewandte Chemie , Des scientifiques chinois décrivent leur conception et la synthèse d'un état amorphe spécial de fer nanoparticulaire, qui peut libérer localement des espèces de fer réactives dans l'environnement acide et riche en peroxyde d'hydrogène des cellules cancéreuses, offrant de nouvelles possibilités pour les thérapies théranostiques et chimiodynamiques.
Les cellules cancéreuses se caractérisent par leur environnement cellulaire relativement acide et leur production de quantités importantes de peroxyde d'hydrogène par rapport aux cellules saines. Certaines approches chimiodynamiques pour le traitement du cancer utilisent ainsi la réaction de Fenton, C'est, des ions fer réagissant avec le peroxyde d'hydrogène pour produire des espèces réactives de l'oxygène (ROS), qui à son tour peut endommager et détruire les cellules cancéreuses. Cependant, le transport des ions fer vers les cellules cibles est problématique, et les nanoparticules de fer cristallin ne sont pas aussi efficaces. Par conséquent, Jianlin Shi et Wenbo Bu et leurs groupes à l'Institut de la céramique de Shanghai, en collaboration avec l'Université Fudan de Shanghai, Chine, ont maintenant préparé des nanoparticules de fer dans un amorphe, état vitreux. "De façon intéressante, les nanoparticules de fer(0) amorphe présentent plusieurs propriétés physico-chimiques uniques, " écrivent les scientifiques, et :« Les résultats confirment que les nanoparticules de fer amorphe, peroxyde d'hydrogène, et les conditions acides agissent en synergie pour tuer les cellules."
En plus de leur potentiel en tant que médicaments, d'autres avantages sont un bon contraste pour l'imagerie par résonance magnétique et la possibilité d'un ciblage magnétique. "Idéalement, un transporteur parfait doit libérer sa cargaison immédiatement lorsqu'elle est transférée de conditions neutres à légèrement acides, tels que ceux du microenvironnement tumoral, " écrivent les auteurs. En utilisant l'imagerie par résonance magnétique, ils ont prouvé par des tests in vitro et in vivo que le mécanisme anticipé fonctionnait.
Ciblage magnétique, d'autre part, permet l'administration de médicaments au tissu cible par magnétisation. Les scientifiques ont observé que « un ciblage et une rétention magnétiques efficaces avaient été obtenus in vivo, fournissant une bonne base pour la thérapie chimiodynamique." Cependant, ils disent également que les perspectives futures incluront la modification de la surface des particules pour améliorer encore les performances de ciblage des tumeurs. En un mot, L'approche élégante de la « bulle de bulle » de Shi et Bu, comme ils l'appellent, a produit un petit, cheval de Troie hautement efficace pour le traitement chimiodynamique du cancer, comme indiqué chez la souris. La méthode de préparation présente des conditions douces et offre également des perspectives pour d'autres métaux.