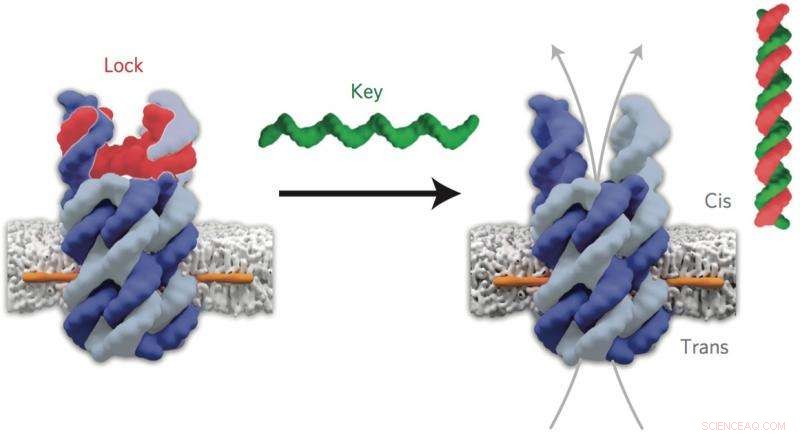
L'ADN « verrou » (rouge) du nanopore fermé se lie à l'ADN « clé » (vert) pour ouvrir le canal. Crédit :Jonathan Burns et al. Nanotechnologie naturelle, DOI 10.1038/nnano.2015.279
L'ADN a été utilisé comme « bloc de construction moléculaire » pour construire des pores synthétiques bio-inspirés qui amélioreront la façon dont les médicaments sont administrés et contribueront à faire progresser le domaine de la biologie synthétique, selon des scientifiques de l'UCL et de Nanion Technologies.
L'étude, publié aujourd'hui dans Nature Nanotechnologie et financé par le Conseil de recherche en biotechnologie et sciences biologiques (BBSRC), Leverhulme Trust et UCL Chimie, montre comment l'ADN peut être utilisé pour construire des pores stables et prévisibles qui ont une forme et une charge définies pour contrôler quelles molécules peuvent traverser le pore et quand.
Auteur principal, Dr Stefan Howorka (UCL Chimie), a déclaré:"Les pores biologiques naturels constitués de protéines sont essentiels pour transporter la cargaison dans et hors des cellules biologiques, mais ils sont difficiles à concevoir à partir de zéro. L'ADN offre une toute nouvelle stratégie pour construire des pores synthétiques hautement spécifiques que nous pouvons ouvrir et fermer à la demande. Nous avons conçu nos pores pour qu'ils agissent comme des portes - la porte ne se déverrouille que lorsqu'elle est fournie avec la bonne clé. En transformant ces pores en supports de médicaments, nous pensons que cela permettra un ciblage beaucoup plus précis de la thérapeutique. »
De nombreux produits thérapeutiques, y compris les médicaments anticancéreux, peuvent être transportés dans le corps dans de minuscules supports appelés vésicules qui ciblent différents tissus à l'aide de marqueurs biologiques. Précédemment, la libération des médicaments de l'intérieur des vésicules a été déclenchée par des parois de vésicules fuyantes induites par la température ou par des canaux peptidiques insérés, qui sont moins rigides et prévisibles que l'ADN.
En utilisant des blocs de construction d'ADN, l'équipe a conçu des pores avec des structures prédéterminées et des propriétés définies qui ont été précisément ancrées dans les parois - ou membranes - des vésicules.
"Nos pores prennent la forme d'un tonneau ouvert composé de six bâtons d'ADN. Nous avons conçu une porte moléculaire pour fermer une entrée, puis rouvrir le canal lorsqu'une molécule spécifique se lie. Des ancres à haute affinité membranaire ont été fixées pour attacher l'eau -pores solubles dans la membrane huileuse, " a expliqué le premier auteur, Dr Jonathan Burns (UCL Chimie).
En utilisant des techniques d'électrophysiologie, les chercheurs ont vérifié que le pore s'étendait verticalement sur la surface de la membrane et était stable avec une largeur interne de 2 nm, qui est une taille appropriée pour que les petites molécules de médicaments passent à travers.
Le mécanisme de verrouillage et de libération de la porte a ensuite été testé avec des techniques d'électrophysiologie ainsi qu'avec des fluorophores, qui sont de taille équivalente à de petites molécules. Comme le pore d'ADN avait une charge négative nette, les fluorophores avec une charge nette négative traversent plus facilement que ceux avec une charge nette positive, montrant la sélectivité pour laquelle la cargaison pourrait sortir. Le retrait de la serrure avec une clé correspondante a augmenté le trafic de 140 fois par rapport à une clé dépareillée.
Co-auteur Astrid Seifert qui travaille avec le Dr Niels Fertig chez Nanion Technologies, a déclaré : « Nous avons pu analyser avec précision les performances de chacun des pores que nous avons créés. Nous avons d'abord inséré des pores dans des membranes, puis nous avons testé la réponse biophysique de chaque canal à l'aide de micropuces avancées. pores spécifiques mais aussi une méthode automatisée pour tester leurs propriétés in situ, ce qui sera important pour tester les pores utilisés pour l'administration ciblée de médicaments à l'avenir. »
Les chercheurs prévoient de tester les pores synthétiques dans divers scénarios, notamment la libération de médicaments anticancéreux dans les cellules et le développement de pores qui libèrent des biomolécules pharmaceutiquement actives.
Dr Howorka a ajouté, "Notre approche est un grand pas en avant dans la construction et l'utilisation de structures biologiques synthétiques et promet une nouvelle ère dans la conception des pores et la biologie synthétique. Nous avons démontré un contrôle si précis du comportement du pore, tant en termes de sélectivité qu'en termes de réactivité, nous pensons que la méthode ouvre la voie à un large éventail d'applications allant de l'administration de médicaments à la nanodétection."