Les chemins empruntés par les particules fluorescentes lorsqu'elles diffusent à travers une structure poreuse à l'échelle nanométrique révèlent la disposition des pores grâce à une technique développée par des scientifiques de l'Université Rice. Crédit :Groupe de Recherche Landes/Université du Riz
Les scientifiques de l'Université Rice ont mené un projet pour « voir » et mesurer l'espace dans les matériaux poreux, même si cet espace est trop petit ou fragile pour les microscopes traditionnels.
Le laboratoire Rice de la chimiste Christy Landes a inventé une technique pour caractériser de tels espaces à l'échelle nanométrique, une avancée importante vers le projet en cours de son groupe pour séparer efficacement les "protéines d'intérêt" pour la fabrication de médicaments. Il devrait également bénéficier à l'analyse des matériaux poreux de toutes sortes, comme les cristaux liquides, hydrogels, des polymères et même des substances biologiques comme le cytosol, les fluides compartimentés dans les cellules.
La recherche avec des collaborateurs de l'Université de Californie, Los Angeles (UCLA) et Kansas State University apparaissent dans la revue American Chemical Society ACS Nano .
Il est facile d'utiliser un composé chimique fluorescent pour marquer, ou "étiquette, " un matériau et prenez-le en photo, dit Landes. "Mais que se passe-t-il si la chose dont vous voulez une photo n'est presque rien ? C'est le problème que nous avons dû résoudre pour comprendre ce qui se passait dans le matériau de séparation."
L'équipe vise à améliorer la séparation des protéines dans un processus appelé chromatographie, dans lequel les solutions s'écoulent à travers un matériau poreux dans une colonne. Parce que différents matériaux voyagent à des vitesses différentes, les composants se séparent et peuvent être purifiés.
"Nous avons appris que dans l'agarose, un matériau poreux utilisé pour séparer les protéines, le regroupement des charges est très important, " a déclaré Landes. Alors que le projet de protéine a réussi, « quand nous avons fait correspondre les données expérimentales à notre théorie, il y avait quelque chose de plus qui contribuait à la séparation que nous ne pouvions pas expliquer."
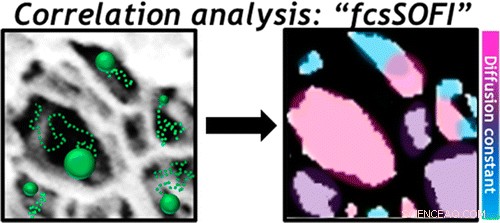
La réponse semblait être la façon dont les particules chargées comme les ligands nanométriques se sont arrangées dans les pores. "C'était la seule explication possible, " Landes a déclaré. "Nous avions donc besoin d'un moyen d'imager les pores."
Des techniques standard comme la force atomique, La microscopie à rayons X et électronique nécessiterait que les échantillons soient congelés ou séchés. "Cela réduirait ou gonflerait ou modifierait leurs structures, " elle a dit.
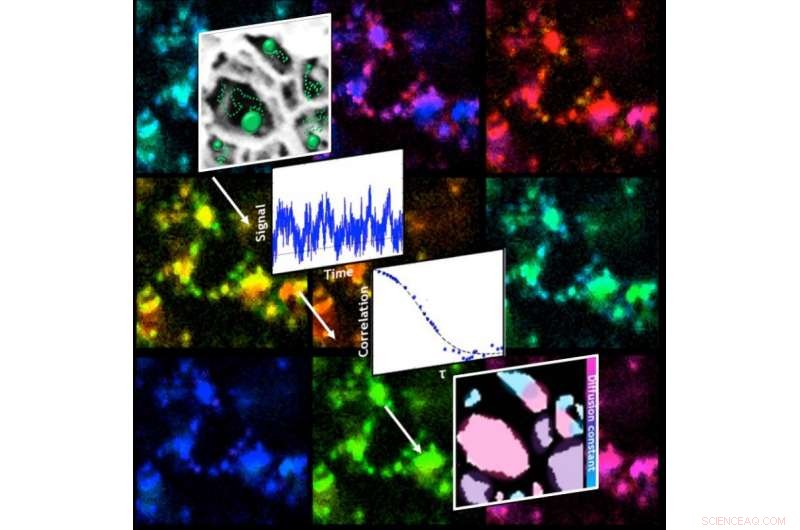
Il est venu à l'esprit de l'équipe de combiner leur expérience avec les techniques de microscopie à super-résolution et de spectroscopie de corrélation de fluorescence, lauréates du prix Nobel. La microscopie à super-résolution est un moyen de voir des objets à des résolutions inférieures à la limite de diffraction, qui restreint la vision des choses qui sont plus petites que la longueur d'onde de la lumière dirigée vers elles.
La spectroscopie de corrélation est un moyen de mesurer les particules fluorescentes lorsqu'elles fluctuent. En analysant les données collectées via une combinaison de microscopie à super-résolution et de spectroscopie de corrélation, les chercheurs ont cartographié des tranches du matériau pour voir où les particules chargées avaient tendance à se regrouper.
La technique combinée, qu'ils appellent fcsSOFI (pour "fluorescence corrélation spectroscopy super-resolution Optical fluctuation imaging"), mesure les tags fluorescents lors de leur diffusion dans les pores, qui permet aux chercheurs de caractériser simultanément les dimensions et la dynamique au sein des pores. Le laboratoire a testé sa technique sur des hydrogels d'agarose mous et des cristaux liquides lyotropes. Prochain, ils prévoient d'étendre leur cartographie aux espaces tridimensionnels.
« Nous avons maintenant les deux pièces de notre puzzle :nous pouvons voir nos protéines interagir avec des charges au sein de notre matériau poreux, et nous pouvons mesurer les pores, " Landes a déclaré. "Cela a un rapport direct avec le problème de séparation des protéines pour l'industrie pharmaceutique de 100 milliards de dollars."