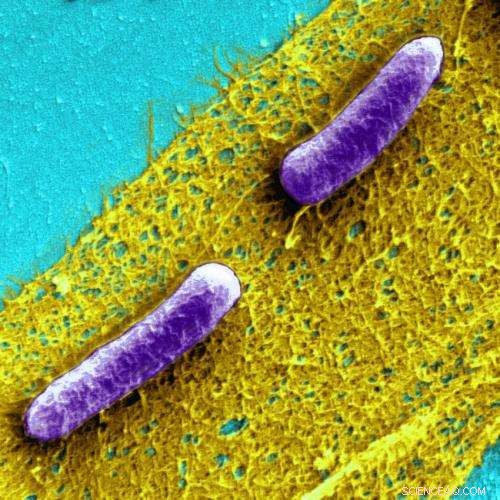
Les biofilms sont des communautés de bactéries ( E. coli sont représentés ici en violet) enfermés dans un gluant, mais matrice extrêmement dure de matériel extracellulaire. Crédit :Institut Wyss de Harvard
Pour la plupart des gens, les biofilms évoquent des images de pierres glissantes dans le lit d'un cours d'eau et de drains sales. Bien qu'il existe de nombreux "mauvais" biofilms autour - ils causent même une plaque dentaire embêtante et une foule d'autres problèmes médicaux plus graves - une équipe du Wyss Institute for Biologically Inspired Engineering de l'Université Harvard considère les biofilms comme une nouvelle plate-forme robuste pour les nanomatériaux de conception. qui pourrait nettoyer les rivières polluées, fabriquer des produits pharmaceutiques, fabriquer de nouveaux textiles, et plus.
En bref, ils veulent donner un coup de jeune aux biofilms, et ont développé un nouveau système d'ingénierie des protéines appelé BIND pour ce faire. En utilisant BIND, qui signifie Biofilm-Integrated Nanofiber Display, l'équipe a déclaré que les biofilms pourraient être les fonderies vivantes de demain pour la production à grande échelle de biomatériaux pouvant être programmés pour fournir des fonctions impossibles avec les matériaux existants. Ils ont rapporté la preuve de concept dans Communication Nature .
"La plupart des recherches liées aux biofilms aujourd'hui se concentrent sur la façon de se débarrasser des biofilms, mais nous démontrons ici que nous pouvons concevoir ces matériaux naturels super résistants pour remplir des fonctions spécifiques - nous pouvons donc les vouloir en quantités spécifiques et pour des applications spécifiques, " a déclaré Neel Joshi, membre du corps professoral du Wyss Institute, Doctorat., l'auteur principal de l'étude. Joshi est également professeur agrégé de génie chimique et biologique à la Harvard School of Engineering and Applied Sciences (SEAS).
Les biofilms s'auto-assemblent et s'auto-cicatrisent également. « S'ils sont endommagés, ils repoussent car ce sont des tissus vivants, " a déclaré l'auteur principal Peter Nguyen, Doctorat., un boursier postdoctoral au Wyss Institute et à Harvard SEAS.
Les biofilms sont des communautés de bactéries nichées dans une matière visqueuse, mais extrêmement dur, matrice de matériel extracellulaire composée de sucres, protéines, matériel génétique et plus encore. Au cours de la formation du biofilm, des bactéries individuelles pompent des protéines qui s'auto-assemblent à l'extérieur de la cellule - créant des réseaux de fibres enchevêtrées qui collent essentiellement les cellules ensemble dans des communautés qui gardent les bactéries plus sûres qu'elles ne le seraient seules.
L'intérêt pour l'ingénierie des biofilms monte en flèche, et tandis que plusieurs autres équipes ont récemment développé des outils génétiques pour contrôler la formation de biofilm, L'équipe de Joshi a modifié la composition du matériel extracellulaire lui-même, le transformant essentiellement en une plate-forme de production auto-répliquante pour produire le matériel qu'ils souhaitent produire.
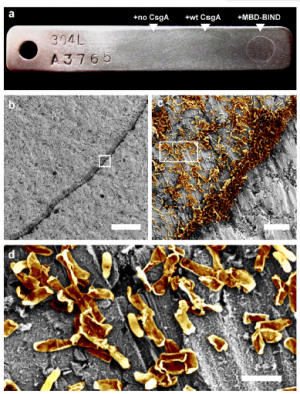
L'équipe de Joshi a démontré sa capacité à programmer E. coli biofilms pour coller à certains substrats, comme l'acier inoxydable. Ils ont fusionné une protéine appelée MBD à la protéine CsgA pour développer un biofilm, qu'ils ont laissé adhérer à l'acier pendant 48 heures, puis ont confirmé à l'aide d'un microscope électronique à balayage (MEB) que le biofilm a résisté à une procédure de lavage vigoureuse (comme indiqué en c-d). Crédit :Institut Wyss de Harvard
« Jusqu'à récemment, il n'y avait pas assez de coopération entre les biologistes de synthèse et les chercheurs en biomatériaux pour exploiter le potentiel synthétique des biofilms de cette façon. Nous essayons de combler ce fossé, " dit Joshi.
L'équipe a génétiquement fusionné une protéine avec une fonction souhaitée particulière - par exemple, un connu pour adhérer à l'acier - sur une petite protéine appelée CsgA qui est déjà produite par E. coli bactéries. Le domaine annexé a ensuite suivi le processus naturel par lequel CsgA est sécrétée à l'extérieur de la cellule, où il s'est auto-assemblé en protéines ultrarésistantes appelées nanofibres amyloïdes. Ces protéines amyloïdes ont conservé la fonctionnalité de la protéine ajoutée - assurant dans ce cas que le biofilm adhère à l'acier.
Les protéines amyloïdes ont traditionnellement mauvaise réputation pour leur rôle dans l'apparition d'énormes problèmes de santé tels que la maladie d'Alzheimer, mais dans ce cas, leur rôle est fondamental pour rendre BIND si robuste. Ces amyloïdes peuvent s'assembler spontanément en fibres qui, par poids, sont plus solides que l'acier et plus rigides que la soie.
« Nous sommes enthousiasmés par la polyvalence de la méthode, trop, " a déclaré Joshi. L'équipe a démontré une capacité à fusionner 12 protéines différentes à la protéine CsgA, avec des séquences et des durées très variables. Cela signifie en principe qu'ils peuvent utiliser cette technologie pour afficher pratiquement n'importe quelle séquence de protéines - une caractéristique importante car les protéines remplissent un éventail de fonctions impressionnantes allant de la liaison à des particules étrangères à la réalisation de réactions chimiques, transmettre des signaux, fournir un soutien structurel, et le transport ou le stockage de certaines molécules.
Non seulement ces fonctions peuvent être programmées dans le biofilm une à la fois, mais ils peuvent également être combinés pour créer des biofilms multifonctionnels.
Le concept d'usine microbienne n'est pas nouveau, mais pour la première fois, il est appliqué aux matériaux, par opposition aux molécules solubles comme les médicaments ou les carburants. "Nous programmons essentiellement les cellules pour qu'elles soient des usines de fabrication, " a déclaré Joshi. "Ils ne produisent pas seulement une matière première en tant que bloc de construction, ils orchestrent l'assemblage de ces blocs en structures d'ordre supérieur et maintiennent cette structure au fil du temps."
"Le travail fondamental que Neel et son équipe font avec les biofilms offre un aperçu d'un avenir beaucoup plus durable sur le plan environnemental où des usines gigantesques sont réduites à la taille d'une cellule que nous pouvons programmer pour fabriquer de nouveaux matériaux qui répondent à nos besoins quotidiens - des textiles aux assainissement énergétique et environnemental, " a déclaré le directeur fondateur du Wyss Institute, Don Ingber, MARYLAND., doctorat
Pour l'instant, l'équipe a démontré sa capacité à programmer E. coli des biofilms qui adhèrent à certains substrats, comme l'acier, d'autres qui peuvent immobiliser un ensemble de protéines ou promouvoir la modélisation de l'argent pour la construction de nanofils.