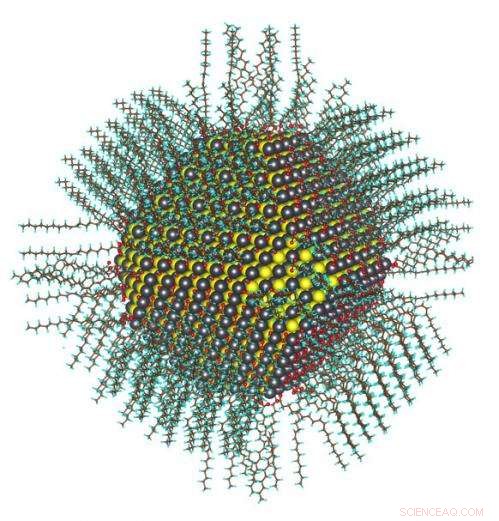
Cette image montre la structure atomique calculée d'un nanocristal de 5 nm de diamètre passivé avec des ligands oléate et hydroxyle. Crédit :Berkeley Lab
Danylo Zherebetskyy et ses collègues du laboratoire national Lawrence Berkeley du département américain de l'Énergie (Berkeley Lab) ont trouvé des traces inattendues d'eau dans des nanocristaux semi-conducteurs.
L'eau en tant que source de petits ions pour la surface des nanoparticules colloïdales de sulfure de plomb (PbS) a permis à l'équipe d'expliquer comment la surface de ces particules importantes est passivée, ce qui signifie comment ils parviennent à un équilibre global d'ions positifs et négatifs. C'est une grande question depuis une quinzaine d'années, et la réponse se lave dans les groupes hydroxyle de l'eau qui avait été pensé pour ne pas être là.
"La passivation est requise principalement dans les solutions colloïdales, qui est le moyen bon marché de produire des nanoparticules. Imaginez la surface de la nanostructure :il y a des ligands, aussi appelés tensioactifs, se lier à la surface, " explique Zherebetskyy. " Les tensioactifs définissent une grande partie des propriétés chimiques et physiques des nanoparticules. "
"On peut synthétiser une très belle nanostructure, et savoir contrôler même la forme. Mais comment contrôler la forme est lié à la façon dont vous passivez une surface pendant le processus de croissance, et exactement comment les ligands passivent la surface [et comment les structures électroniques se produisent] n'a jamais été bien compris, " ajoute Lin-Wang Wang, scientifique senior au Berkeley Lab et chef du groupe Computational Material Science et Nano Science du Berkeley Lab.
La première étape de la fabrication d'un nanocristal de PbS consiste à dissoudre l'oxyde de plomb dans de l'acide oléique chaud. Cela forme l'une des molécules précurseurs, qui est du plomb plus de longs ligands oléates, et un sous-produit de l'eau. "Vous chauffez les précurseurs [pour les sécher], alors les gens pensaient que toute l'eau s'était évaporée, " explique Wang.
"Les gens étaient vraiment perplexes quant à la façon dont la surface peut être passive, " poursuit-il. Les nanocristaux ont un excès d'ions plomb par rapport au sulfate, ce qui signifie qu'un tensioactif de charge 2 est nécessaire pour passiver chaque ion plomb 2+ supplémentaire. Chaque molécule d'acide oléique (oléate) a une charge 1-, mais les expériences montrent que le nombre d'atomes de plomb supplémentaires est à peu près égal au nombre d'oléates. Il n'est donc pas logique que le précurseur se comporte comme s'il était passivé.
Mais faire des calculs et suivre les processus de synthèse a suggéré à Zherebetskyy et Wang qu'il pourrait encore y avoir de l'eau dans les molécules précurseurs :en effet, une série d'expériences spectroscopiques a montré que l'eau se lie fortement aux précurseurs et sert de source de groupes hydroxyle, charge 1-, qui peut aussi permettre la passivation.
"Les oléates sont gros. Imaginez-les comme un tube, " explique Zherebetskyy. " Le rayon de ce tube est trop grand pour former un emballage si dense qui passive complètement les atomes de plomb. " C'est, ils sont trop gros pour s'entasser autour du plomb sans interférer les uns avec les autres. Ses recherches étaient un effort pour trouver «quelque chose d'autre» était nécessaire pour passiver complètement le nanocristal.
Lorsque l'équipe a découvert que l'eau se lie fortement à l'oléate de plomb précurseur, au point que moins de la moitié de celui-ci est éliminé lors du processus de synthèse et de déshydratation, ils avaient découvert la source de petits groupes hydroxyle qui se lient au plomb entre les oléates.
Ces résultats ont été rapportés dans un Science article intitulé "Hydroxylation de la surface des nanocristaux de PbS passivés avec de l'acide oléique." Wang est l'auteur correspondant et Zherebetskyy est le principal. Les autres auteurs sont Marcus Scheele, Yingjie Zhang, Noé Bronstein, Christophe Thompson, David Britt, Miquel Salmeron et Paul Alivisatos.
"Il est très difficile de détecter l'hydroxyle car l'eau est partout; les pics spectroscopiques d'hydroxyle peuvent être confondus avec ceux de l'eau, et votre échantillon pourrait ne pas être pur, " dit Wang. " Nous avons utilisé toutes les techniques de spectroscopie. "
Noah Bronstein a vu une caractéristique très intéressante lors d'observations de routine au microscope électronique à transmission (MET) lors de la synthèse de particules :seules les facettes riches en plomb de la molécule de PbS étaient recouvertes d'oléates. C'était la première observation à suggérer que la théorie de Zherebetskyy et Wang avait raison :« Ils avaient prédit que l'énergie de liaison du ligand sur la facette riche en plomb devrait être beaucoup plus élevée, " dit Bronstein.
L'autre facette du nanocristal, avec du plomb et du soufre exposés, était dépourvu de ligands. "Une fois que nous avons vu cela, nous avons essayé d'autres choses pour rechercher de l'eau dans le précurseur de plomb; ou hydroxyle sur la surface des nanoparticules, " ajoute Bronstein. Il a utilisé la spectroscopie infrarouge pour vérifier la présence d'eau sur les précurseurs d'oléates de plomb, et la résonance magnétique nucléaire pour montrer que l'oléate de plomb a agi comme un agent de séchage, extraire l'eau du solvant. Lors de la synthèse, les groupes hydroxyle de l'eau sont restés étroitement liés à l'oléate de plomb.
"Mais la spectroscopie de photoémission aux rayons X (XPS) était vraiment la solution miracle qui montrait la présence d'hydroxyle, " dit Bronstein.
Yingjie Zhang a mené des expériences XPS pour fournir la preuve directe que les groupes hydroxyle restent liés à la surface. "Vous avez besoin de plusieurs échantillons de contrôle - un nanocristal de PbS avec un précurseur d'oxyde de plomb et un autre précurseur qui n'implique pas d'eau lors de la synthèse, " dit-il. Pour y parvenir, il a utilisé un échantillon de nanocristal produit à partir de chlorure de plomb au lieu d'oxyde de plomb, de telle sorte qu'il n'y avait aucun moyen de générer de l'eau dans la réaction avec l'acide oléique. À la fin, il a observé un pic d'émission d'oxygène d'un nanocristal et un pic de chlore de l'autre, prouvant qu'il y a bien de l'hydroxyle à la surface du PbS synthétisé à partir de précurseurs d'oxyde de plomb.
« Depuis que les nanoparticules ont commencé à être implémentées dans les premiers prototypes de dispositifs, les gens ont demandé ce qui se passe à la surface et comment nous pouvons ajuster les propriétés en changeant les molécules organiques à la surface, " dit Zherebetskyy.
Et il n'y a pas que le PbS – de nombreuses autres nanoparticules sont synthétisées de la même manière à l'aide d'acide oléique ou d'autres grands ligands. Savoir comment les nanoparticules sont passivées offre l'opportunité d'envisager des moyens d'ingénierie des structures de surface afin d'affiner leurs propriétés électriques pour une gamme d'applications.