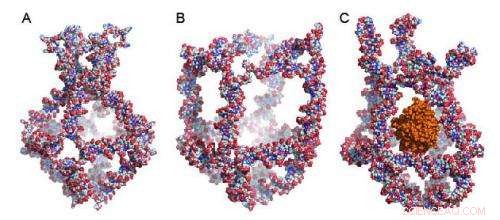
La figure montre une nanocage dans laquelle huit molécules d'ADN uniques sont mélangées. La nanocage comporte quatre éléments fonctionnels qui se transforment en réponse aux changements de température ambiante. Ces transformations ferment (1A) ou ouvrent (1B) la nanocage. En exploitant les changements de température dans l'environnement, les chercheurs ont piégé une enzyme active appelée peroxydase de raifort (HRP) dans la nanocage (1C). Crédit :Sissel Juul
Un nanorobot est un terme courant pour désigner des molécules possédant une propriété unique qui leur permet d'être programmées pour effectuer une tâche spécifique. En collaboration avec des collègues en Italie et aux États-Unis, Des chercheurs de l'Université d'Aarhus ont maintenant franchi une étape majeure vers la construction du premier nanorobot de molécules d'ADN capable d'encapsuler et de libérer des biomolécules actives.
À l'heure, le nanorobot (également appelé nanocage à ADN) sera sans aucun doute utilisé pour transporter des médicaments dans le corps et ainsi avoir un effet ciblé sur les cellules malades.
Conception utilisant les molécules naturelles du corps
En utilisant l'auto-assemblage d'ADN, les chercheurs ont conçu huit molécules d'ADN uniques à partir des propres molécules naturelles du corps. Lorsque ces molécules sont mélangées, ils s'agrègent spontanément sous une forme utilisable – la nanocage (voir figure).
La nanocage comporte quatre éléments fonctionnels qui se transforment en réponse aux changements de température ambiante. Ces transformations ferment (figure 1A) ou ouvrent (figure 1B) la nanocage. En exploitant les changements de température dans l'environnement, les chercheurs ont piégé une enzyme active appelée peroxydase de raifort (HRP) dans la nanocage (figure 1C). Ils ont utilisé HRP comme modèle car son activité est facile à retracer.
Ceci est possible parce que le réseau externe de la nanocage a des ouvertures avec un diamètre plus petit que la cavité sphérique centrale. Cette structure permet d'encapsuler des enzymes ou d'autres molécules plus grandes que les ouvertures du réseau, mais plus petit que la cavité centrale.
Les chercheurs viennent de publier ces résultats dans la célèbre revue ACS Nano . Ici, les chercheurs montrent comment ils peuvent utiliser les changements de température pour ouvrir la nanocage et permettre à la HRP d'être encapsulée avant qu'elle ne se referme.
Ils montrent également que HRP conserve son activité enzymatique à l'intérieur de la nanocage et convertit les molécules de substrat suffisamment petites pour pénétrer dans la nanocage en produits à l'intérieur.
L'encapsulation de HRP dans la nanocage est réversible, de telle sorte que la nanocage soit capable de libérer à nouveau le HRP en réaction aux changements de température. Les chercheurs montrent également que la nanocage à ADN – avec sa charge enzymatique – peut être absorbée par des cellules en culture.
En regardant vers l'avenir, le concept derrière cette nanocage devrait être utilisé pour l'administration de médicaments, c'est-à-dire comme moyen de transport pour les médicaments qui peuvent cibler les cellules malades dans le corps afin d'obtenir un effet plus rapide et plus bénéfique.