
Les chercheurs diplômés du MIT, Robert Mitchell et Betar Gallant, connectent une batterie Li-air utilisée pour préparer les échantillons pour la caractérisation in situ au microscope électronique à transmission (MET). Crédit :JIN SUNTIVICH
L'un des nouveaux types de batteries les plus prometteurs pour alimenter les voitures électriques s'appelle une batterie lithium-air, qui pourrait stocker jusqu'à quatre fois plus d'énergie par livre que les meilleures batteries lithium-ion d'aujourd'hui. Mais les progrès ont été lents :la nature des réactions électrochimiques au fur et à mesure que ces batteries sont chargées reste mal connue.
Des chercheurs du MIT et des laboratoires nationaux Sandia ont utilisé l'imagerie au microscope électronique à transmission (MET) pour observer, au niveau moléculaire, ce qui se passe au cours d'une réaction appelée dégagement d'oxygène lorsque les batteries lithium-air se chargent ; cette réaction est considérée comme un goulot d'étranglement limitant d'autres améliorations à ces batteries. La technique TEM pourrait aider à trouver des moyens de rendre ces batteries pratiques dans un proche avenir.
Le travail est décrit dans un Lettres nano article de Robert Mitchell, qui a récemment obtenu un doctorat en science et ingénierie des matériaux du MIT; étudiant au doctorat en génie mécanique Betar Gallant; Carl Thompson, le professeur Stavros Salapatas de science et ingénierie des matériaux; Yang Shao-Horn, le professeur agrégé Gail E. Kendall de génie mécanique et de science et génie des matériaux; et quatre autres auteurs.
Oxydation en action
Les nouvelles observations montrent, pour la première fois, l'oxydation du peroxyde de lithium, le matériau formé lors de la décharge dans une batterie lithium-air. À des taux de charge élevés, cette oxydation se produit majoritairement à la frontière entre le peroxyde de lithium et le substrat carboné sur lequel il croît lors de la décharge - en l'occurrence, nanotubes de carbone multiparois utilisés dans l'électrode de la batterie.
Le confinement à cette interface, Shao-Horn dit, montre que c'est la résistance du peroxyde de lithium à un flux d'électrons qui limite la charge de telles batteries dans des conditions de charge pratiques.
Une pointe de sonde revêtue d'électrolyte sert d'électrode opposée pour éliminer les ions lithium pendant la charge, à mesure que les électrons traversent la structure des nanotubes vers le circuit externe. Pendant la charge, les particules de peroxyde de lithium se rétractent à partir de l'interface nanotube-peroxyde, montrant que l'oxydation se produit là où il est le plus facile d'éliminer les électrons.
"Le transport du lithium peut suivre, " Shao-Horn dit, ce qui indique que le transport d'électrons pourrait être une limite critique sur la charge des batteries pour les véhicules électriques.
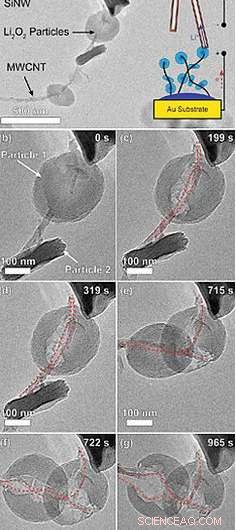
Oxydation de particules de Li2O2 dans une batterie nanométrique de microscope électronique à transmission (MET) in situ. Crédit :MITCHELL, GALLANT ET SHAO-HORN
Charge plus rapide
En réalité, le taux d'oxydation du peroxyde de lithium dans ces expériences était environ 100 fois plus rapide que le temps de charge des batteries lithium-air à l'échelle du laboratoire, et aborde ce qui est nécessaire pour les applications. Cela démontre que si les caractéristiques de transfert d'électrons de ces batteries peuvent être améliorées, cela pourrait permettre une charge beaucoup plus rapide tout en minimisant les pertes d'énergie.
« Cela donne un aperçu de la façon de concevoir l'électrode à air, " dit Shao-Horn. " A notre connaissance, c'est la première preuve directe que le transport des électrons limite la charge."