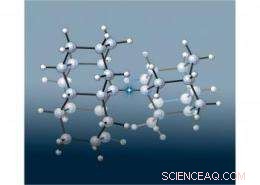
Une équipe de scientifiques européens et du SLAC a rejoint deux minuscules structures « diamondoïdes » en forme de diamant pour créer la plus longue liaison carbone-carbone (mise en évidence sur cette image par l'étoile) jamais vue dans un alcane, une classe de molécules constituées uniquement de carbone et d'hydrogène reliés par des liaisons covalentes simples. Ce qui était surprenant, cependant, était que la molécule était beaucoup plus stable que prévu, puisque les liaisons plus longues sont généralement plus faibles. Les chercheurs ont déterminé que les forces d'attraction entre les diamantoïdes renforçaient la stabilité de cette molécule. Image de Peter R. Schreiner, Université Justus-Liebig, Allemagne.
(PhysOrg.com) -- La force d'une liaison chimique entre les atomes est la base fondamentale de la stabilité et de la réactivité d'une molécule. Le réglage de la force et de l'accessibilité de la liaison peut modifier considérablement les propriétés d'une molécule. Par exemple, la force d'une liaison est directement liée à sa longueur :étirer une liaison au-delà de sa longueur normale la rend plus faible.
Mais de nouvelles recherches menées par une équipe de deux universités européennes et du SLAC National Accelerator Laboratory montrent que les forces d'attraction entre d'autres parties d'une molécule peuvent rendre une liaison étirée joignant deux atomes de carbone beaucoup plus stable que prévu. Ce résultat devrait conduire à des améliorations dans la façon dont les scientifiques conçoivent de nouvelles molécules, matériaux et catalyseurs.
« Nous comprenons pourquoi les molécules avec des liaisons exceptionnellement longues ne doivent pas nécessairement être instables, " a déclaré Jérémy Dahl, un scientifique du Stanford Institute for Materials &Energy Science (SIMES), un institut géré conjointement par le SLAC et l'Université de Stanford. Les collaborateurs étaient Peter R. Schreiner de l'Université Justus-Liebig en Allemagne et Andrey A. Fokin de l'Institut polytechnique de Kiev en Ukraine. Les résultats sont publiés aujourd'hui dans La nature .
Bien qu'applicable à tous les types de molécules, la nouvelle recherche porte sur les alcanes, une classe de molécules composées uniquement d'atomes de carbone et d'hydrogène reliés par des liaisons covalentes simples, et les diamantoïdes, qui sont des diamants de la taille d'une molécule mis au point par les chercheurs du SIMES. Éthane, le propane et l'octane sont des alcanes familiers qui ont des épines dorsales de deux, trois et huit atomes de carbone, respectivement, tous reliés par des liaisons simples. Les atomes de carbone dans les diamantoïdes extrêmement rigides sont disposés dans la même forme tétraédrique que le diamant.
Dans leurs nouvelles recherches, les scientifiques ont joint des paires de diamantoïdes pour créer trois nouveaux alcanes qui avaient une liaison carbone-carbone ultra-longue au milieu. Pour accueillir les diamantoïdes volumineux, la liaison centrale devait s'étendre bien au-delà de la longueur normale de liaison carbone-carbone de 1,54 angström. (Un angström, ou , est un dixième de nanomètre.) L'une des nouvelles molécules avait la plus longue liaison carbone-carbone jamais mesurée dans un alcane :1,704Å.
Étonnamment, ces nouvelles molécules à double diamant se sont avérées beaucoup plus stables que prévu. Des recherches antérieures menées par d'autres groupes avaient montré qu'un alcane avec une liaison carbone-carbone de 1,65 survivait moins d'une heure à 167C (333F). En revanche, la liaison centrale carbone-carbone de deux des nouvelles molécules de diamants liés ne s'est séparée qu'après avoir été chauffée au-dessus de 300C (572F). Le troisième, avec la liaison carbone-carbone 1.704Å, a duré jusqu'à ce qu'il soit chauffé à 220C (428F).
« Sur la base de la longueur de la liaison carbone-carbone uniquement, Je m'attendais à ce que ces molécules diamantoïdes soient beaucoup moins stables qu'elles ne l'ont prouvé, », a déclaré Schreiner. "Il devait se passer autre chose pour garder ces nouvelles molécules ensemble."
Qu'est-ce qui a fait la différence ? Structure cristalline aux rayons X, résonance magnétique nucléaire, et des études thermogravimétriques réalisées par les collègues européens de Dahl ont montré que même lorsque les liens s'étiraient, les forces attractives entre les deux diamantoïdes les rapprochaient. Ces forces d'attraction sont généralement observées entre des molécules séparées, où elles sont appelées forces de van der Waals d'après le physicien néerlandais qui les a décrites pour la première fois en 1873. « Les scientifiques ne tiennent généralement pas compte des attractions de van der Waals lorsqu'ils analysent la stabilité d'une seule molécule, mais il semble maintenant qu'ils devraient, », a déclaré Dahl.
Les résultats de la recherche du groupe ont été étayés par des calculs sophistiqués qui ont permis aux scientifiques d'activer et de désactiver les forces d'attraction lorsqu'ils ont évalué la stabilité des nouvelles molécules.
Schreiner a ajouté que cette découverte peut expliquer pourquoi l'analyse conventionnelle prédit que les alcanes ramifiés - qui contiennent de grands groupes d'atomes attachés au squelette alcane - sont beaucoup moins stables qu'ils ne le sont réellement, et pourquoi les diamantoïdes ont des points de fusion beaucoup plus élevés que prévu.
Ces résultats sont les derniers de plusieurs découvertes et applications intéressantes pour les diamantoïdes depuis que Dahl et son collègue Robert Carlson ont développé un moyen d'isoler des quantités importantes d'entre eux du pétrole brut en 2003.
Parmi leurs propriétés intéressantes, les diamantoïdes émettent des électrons de manière extrêmement efficace. Dans un ouvrage publié dans Science en 2007, Les scientifiques du SIMES Zhi-Xun Shen, Wanli Yang et Nick Melosh – en plus de Dahl, Carlson et le groupe Schreiner - ont montré que les diamantoïdes émettent facilement des électrons sur une plage d'énergie très étroite, une propriété qui pourrait améliorer les capacités d'imagerie de plusieurs types de microscopes électroniques ainsi que la modélisation par faisceau d'électrons utilisée pour fabriquer des puces informatiques.
Les diamantoïdes sont également hautement personnalisables, ce qui signifie que différentes variétés peuvent être produites et modifiées pour répondre à différentes spécifications :cristaux tridimensionnels pour les applications nécessitant un matériau en poudre, films bidimensionnels pour le revêtement d'autres matériaux, et éventuellement même des nanofils unidimensionnels pour le transfert de charge ou de lumière.
« Ces derniers résultats montrent que la fabrication de molécules sous de nouvelles formes et tailles peut conduire à des découvertes surprenantes, », a déclaré Dahl.