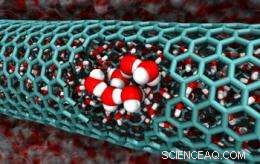
Cette image des simulations de l'équipe Caltech présente une coupe d'un nanotube de carbone de 2,0 nanomètres de diamètre, révélant des molécules d'eau confinées. [Crédit :Caltech/Tod Pascal]
Les scientifiques découvrent souvent des choses étranges et inattendues lorsqu'ils examinent des matériaux à l'échelle nanométrique - le niveau d'atomes et de molécules uniques. Cela est vrai même pour les matériaux les plus courants, comme l'eau.
Exemple :au cours des deux dernières années, des chercheurs ont observé que l'eau s'écoule spontanément dans des tubes extrêmement petits de graphite ou de graphène, appelés nanotubes de carbone. Cette observation inattendue est intrigante car les nanotubes de carbone sont prometteurs dans les domaines émergents de la nanofluidique et de la nanofiltration, où les nanotubes pourraient aider à maintenir de minuscules flux ou à séparer les impuretés de l'eau. Cependant, personne n'a réussi à expliquer pourquoi, au niveau moléculaire, un liquide stable voudrait se cantonner à une si petite zone.
Maintenant, en utilisant une nouvelle méthode pour calculer la dynamique des molécules d'eau, Les chercheurs de Caltech pensent avoir résolu le mystère. Il s'avère que l'entropie, une mesure du désordre, a été la clé manquante.
"C'est un résultat assez surprenant, " dit Guillaume Goddard, le professeur de chimie Charles et Mary Ferkel, La science des matériaux, et physique appliquée à Caltech et directeur du Materials and Process Simulation Center. "Les gens se concentrent normalement sur l'énergie dans ce problème, pas d'entropie."
C'est parce que l'eau forme un vaste réseau de liaisons hydrogène, ce qui le rend très stable. Briser ces interactions fortes nécessite de l'énergie. Et comme certaines liaisons doivent être rompues pour que l'eau s'écoule dans de petits nanotubes, il semblerait peu probable que l'eau le fasse librement.
"Ce que nous avons découvert, c'est qu'il s'agit en fait d'un compromis, " Goddard dit. " Vous perdez une partie de cette bonne stabilisation énergétique de la liaison, mais dans le processus, vous gagnez en entropie."
L'entropie est l'une des forces motrices qui déterminent si un processus se produira spontanément. Il représente le nombre de façons dont un système peut exister dans un état particulier. Plus un système dispose d'arrangements, plus son désordre est grand, et plus l'entropie est élevée. Et en général, la nature va vers le désordre.
Lorsque l'eau est idéalement liée, toutes les liaisons hydrogène bloquent les molécules en place, restreindre leur liberté et maintenir l'entropie de l'eau à un niveau bas. Ce que Goddard et le chercheur postdoctoral Tod Pascal ont découvert, c'est que dans le cas de certains nanotubes, l'eau gagne suffisamment d'entropie en entrant dans les tubes pour compenser les pertes d'énergie encourues par la rupture de certaines de ses liaisons hydrogène. Par conséquent, l'eau s'écoule spontanément dans les tubes.
Goddard et Pascal expliquent leurs découvertes dans un article récemment publié dans le Actes de l'Académie nationale des sciences (PNAS) . Ils ont examiné des nanotubes de carbone d'un diamètre compris entre 0,8 et 2,7 nanomètres et ont trouvé trois raisons différentes pour lesquelles l'eau s'écoulerait librement dans les tubes, selon le diamètre.
Pour les plus petits nanotubes - ceux entre 0,8 et 1,0 nanomètre de diamètre - les tubes sont si minuscules que les molécules d'eau s'alignent presque en file indienne et prennent un état gazeux. Cela signifie que la structure liée normale de l'eau liquide se décompose, donnant aux molécules une plus grande liberté de mouvement. Cette augmentation d'entropie attire l'eau dans les tubes.
Au niveau supérieur, où les nanotubes ont des diamètres compris entre 1,1 et 1,2 nanomètres, les molécules d'eau confinées s'arrangent en empilement, cristaux glacés. Goddard et Pascal ont découvert que ces nanotubes étaient de la taille parfaite - une sorte de boucle d'or - pour contenir de l'eau cristallisée. Ces interactions de liaison cristalline, pas d'entropie, le rendre favorable pour que l'eau s'écoule dans les tubes.
À la plus grande échelle étudiée, impliquant des tubes dont le diamètre n'est encore que de 1,4 à 2,7 nanomètres de large, les chercheurs ont découvert que les molécules d'eau confinées se comportaient davantage comme de l'eau liquide. Cependant, encore une fois, certaines des liaisons hydrogène normales sont rompues, les molécules présentent donc une plus grande liberté de mouvement dans les tubes. Et les gains d'entropie compensent largement la perte d'énergie de liaison hydrogène.
Parce que l'intérieur des nanotubes de carbone est beaucoup trop petit pour que les chercheurs puissent l'examiner expérimentalement, Goddard et Pascal ont étudié la dynamique des molécules d'eau confinées dans des simulations. En utilisant une nouvelle méthode développée par le groupe de Goddard avec un supercalculateur, ils ont pu calculer l'entropie pour les molécules d'eau individuelles. Autrefois, ces calculs ont été difficiles et extrêmement longs. Mais la nouvelle approche, surnommé le modèle thermodynamique à deux phases, a rendu la détermination des valeurs d'entropie relativement facile pour tout système.
"Les anciennes méthodes prenaient huit ans de temps de traitement informatique pour arriver aux mêmes entropies que nous obtenons maintenant en 36 heures, " dit Goddard.
L'équipe a également effectué des simulations en utilisant une description alternative de l'eau, une description où l'eau avait ses propriétés énergétiques habituelles, densité, et la viscosité, mais manquait de sa liaison hydrogène caractéristique. Dans ce cas, l'eau ne voulait pas s'écouler dans les nanotubes, fournissant une preuve supplémentaire que la faible entropie naturelle de l'eau en raison de la liaison hydrogène étendue conduit à ce qu'elle remplisse spontanément les nanotubes de carbone lorsque l'entropie augmente.
Goddard pense que les nanotubes de carbone pourraient être utilisés pour concevoir des supermolécules pour la purification de l'eau. En incorporant des pores de même diamètre que les nanotubes de carbone, il pense qu'un polymère pourrait être fabriqué pour aspirer l'eau de la solution. Une telle application potentielle souligne la nécessité d'une meilleure compréhension du transport de l'eau à travers les nanotubes de carbone.