
Image de microscopie électronique à balayage d'un film nanocomposite. Crédit d'image:Rensselaer/Ravindra C.Pangule et Shyam Sundhar Bale
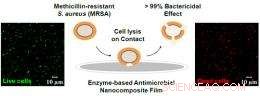
S'appuyant sur une enzyme trouvée dans la nature, des chercheurs du Rensselaer Polytechnic Institute ont créé un revêtement à l'échelle nanométrique pour le matériel chirurgical, murs de l'hôpital, et d'autres surfaces qui éradiquent en toute sécurité les résistances à la méthicilline Staphylococcus aureus (SARM), les bactéries responsables des infections résistantes aux antibiotiques.
"Nous construisons sur la nature, " a déclaré Jonathan S. Dordick, le professeur Howard P. Isermann de génie chimique et biologique, et directeur du Centre de Rensselaer pour la biotechnologie et les études interdisciplinaires. "Ici, nous avons un système où la surface contient une enzyme qui est sûre à manipuler, ne semble pas entraîner de résistance, ne s'infiltre pas dans l'environnement, et ne se bouche pas avec des débris cellulaires. Les bactéries MRSA entrent en contact avec la surface, et ils sont tués."
Dans les essais, 100 pour cent des SARM en solution ont été tués dans les 20 minutes suivant le contact avec une surface peinte avec de la peinture au latex recouverte du revêtement.
Le nouveau revêtement marie les nanotubes de carbone à la lysostaphine, une enzyme naturelle utilisée par des souches non pathogènes de bactéries Staph pour se défendre contre Staphylococcus aureus, y compris le SARM. Le "conjugué" nanotube-enzyme résultant peut être mélangé avec n'importe quel nombre de finitions de surface - dans les tests, il a été mélangé avec de la peinture maison au latex ordinaire.
Contrairement à d'autres revêtements antimicrobiens, il n'est toxique que pour le SARM, ne dépend pas des antibiotiques, et ne lessive pas de produits chimiques dans l'environnement et ne se bouche pas avec le temps. Il peut être lavé à plusieurs reprises sans perdre en efficacité et a une durée de conservation à sec pouvant aller jusqu'à six mois.
La recherche, dirigé par Dordick et Ravi Kane, professeur au Département de génie chimique et biologique de Rensselaer, avec la collaboration de Dennis W. Metzger à Albany Medical College, et Ravi Pangule, un étudiant diplômé en génie chimique sur le projet, a été publié dans l'édition de juillet de la revue ACS Nano , publié par l'American Chemical Society.
Dordick a déclaré que le revêtement nanotube-enzyme s'appuie sur plusieurs années de travaux antérieurs intégrant des enzymes dans des polymères. Dans les études précédentes, Dordick et Kane ont découvert que les enzymes attachées aux nanotubes de carbone étaient plus stables et plus denses lorsqu'elles étaient intégrées dans des polymères que les enzymes seules.
"Si nous mettons une enzyme directement dans un revêtement (comme de la peinture), elle sortira lentement, " a déclaré Kane. " Nous voulions créer un environnement stabilisant, et les nanotubes nous permettent de le faire."
Crédit image :Rensselaer/Ravindra C.Pangule
Ayant établi les bases de l'incorporation d'enzymes dans des polymères, ils ont tourné leur attention vers des applications pratiques.
« Nous nous sommes demandé :y avait-il des exemples dans la nature où des enzymes peuvent être exploitées qui ont une activité contre les bactéries ? » dit Dordick. La réponse a été oui et l'équipe s'est rapidement concentrée sur la lysostaphine, une enzyme sécrétée par des souches de Staph non pathogènes, inoffensif pour l'homme et les autres organismes, capable de tuer Staphylococcus aureus , y compris le SARM, et disponible dans le commerce.
"C'est très efficace. Si vous mettez une petite quantité de lysostaphine dans une solution avec Staphylococcus aureus , vous verrez les bactéries mourir presque immédiatement, " a déclaré Kane.
La lysostaphine agit en s'attachant d'abord à la paroi cellulaire bactérienne, puis en découpant la paroi cellulaire (le nom de l'enzyme dérive du grec "lyse" qui signifie "desserrer ou libérer").
"La lysostaphine est exceptionnellement sélective, " Dordick a dit. " Il ne fonctionne pas contre d'autres bactéries et il n'est pas toxique pour les cellules humaines. "
L'enzyme est attachée au nanotube de carbone avec une courte liaison polymère flexible, ce qui améliore sa capacité à atteindre les bactéries MRSA, dit Kane.
"Plus la lysostaphine est capable de se déplacer, plus il est capable de fonctionner », a déclaré Dordick.
Ils ont testé avec succès le conjugué nanotube-enzyme obtenu à l'Albany Medical College, où Metzger maintient des souches de SARM.
"En fin de compte, nous avons un agent très sélectif qui peut être utilisé dans un large éventail d'environnements - peintures, enrobage, instruments médicaux, boutons de porte, masques chirurgicaux - et c'est actif et c'est stable, " Kane a dit. " Il est prêt à l'emploi quand vous êtes prêt à l'utiliser. "
L'approche nanotube-enzyme est susceptible de s'avérer supérieure aux tentatives précédentes d'agents antimicrobiens, qui se répartissent en deux catégories :les revêtements libérant des biocides, ou des revêtements qui « lancent » des bactéries.
Les revêtements qui libèrent des biocides - qui fonctionnent d'une manière similaire à la peinture antisalissure marine - ont des effets secondaires nocifs et perdent de leur efficacité avec le temps, car leur ingrédient actif s'infiltre dans l'environnement.
Les revêtements qui transpercent les bactéries - utilisant des polycations amphipatiques et des peptides antimicrobiens - ont tendance à se boucher, perd aussi en efficacité.
Le revêtement nanotube-lysostaphine ne fait ni l'un ni l'autre, dit Dordick.
« Nous avons passé pas mal de temps à démontrer que l'enzyme ne sortait pas de la peinture lors des expériences antibactériennes. En effet, il était surprenant que l'enzyme ait fonctionné aussi bien qu'elle l'a fait tout en restant incrustée près de la surface de la peinture, " dit Dordick.
L'action de tranchage ou « lytique » de l'enzyme signifie également que le contenu des cellules bactériennes se disperse, ou peut être enlevé en rinçant ou en lavant la surface.
Kane a également déclaré que le SARM est peu susceptible de développer une résistance à une enzyme naturelle.
"La lysostaphine a évolué sur des centaines de millions d'années pour être très difficile à résister pour Staphylococcus aureus, ", a déclaré Kane. "C'est un mécanisme intéressant que ces enzymes utilisent et dont nous profitons."