
Un champ de cellules cancéreuses de la prostate humaine est montré après exposition à des nanoparticules de carbone activées par laser. Les nombreuses cellules vertes ont adopté un composé thérapeutique modèle, calcéine, tandis que les quelques cellules colorées en rouge sont mortes. Chacun des points verts ou rouges est une seule cellule. Crédit :Crédit :Prerona Chakravarty
En utilisant des "nanoblastes" chimiques qui perforent de minuscules trous dans les membranes protectrices des cellules, des chercheurs ont démontré une nouvelle technique pour obtenir de petites molécules thérapeutiques, protéines et ADN directement dans les cellules vivantes.
Les nanoparticules de carbone activées par des rafales de lumière laser déclenchent les minuscules explosions, qui ouvrent des trous dans les membranes cellulaires juste assez longtemps pour admettre les agents thérapeutiques contenus dans le fluide environnant. En ajustant l'exposition au laser, les chercheurs ont administré un composé marqueur à petites molécules à 90 pour cent des cellules ciblées, tout en maintenant plus de 90 pour cent des cellules en vie.
La recherche a été parrainée par les National Institutes of Health et l'Institute of Paper Science and Technology de Georgia Tech. Il sera rapporté dans le numéro d'août du journal Nature Nanotechnologie .
"Cette technique pourrait nous permettre de fournir une grande variété de thérapies qui ne peuvent maintenant pas facilement pénétrer dans les cellules, " a déclaré Mark Prausnitz, professeur à la School of Chemical and Biomolecular Engineering du Georgia Institute of Technology. "L'une des utilisations les plus importantes de cette technologie pourrait être les thérapies géniques, qui offrent de grandes promesses en médecine, mais dont les progrès ont été limités par la difficulté d'introduire l'ADN et l'ARN dans les cellules.
On pense que ce travail est le premier à utiliser l'activation de nanoparticules de carbone réactives par des lasers pour des applications médicales. Des recherches supplémentaires et des essais cliniques seront nécessaires avant que la technique puisse être utilisée chez l'homme.
Les chercheurs essaient depuis des décennies de conduire l'ADN et l'ARN plus efficacement dans les cellules avec une variété de méthodes, y compris l'utilisation de virus pour transporter du matériel génétique dans les cellules, enrober l'ADN et l'ARN d'agents chimiques ou utiliser des champs électriques et des ultrasons pour ouvrir les membranes cellulaires. Cependant, ces méthodes antérieures ont généralement souffert d'une faible efficacité ou de problèmes de sécurité.
Avec leur nouvelle technique, qui a été inspiré par des travaux antérieurs sur ce qu'on appelle "l'effet photoacoustique, " Prausnitz et ses collaborateurs Prerona Chakravarty, Wei Qian et Mostafa El-Sayed espèrent mieux localiser l'application de l'énergie aux membranes cellulaires, créer une approche plus sûre et plus efficace pour l'administration intracellulaire de médicaments.
Leur technique commence par l'introduction de particules de noir de carbone mesurant 25 nanomètres - un millionième de pouce - de diamètre dans le fluide entourant les cellules dans lesquelles les agents thérapeutiques doivent être introduits. Des rafales de lumière proche infrarouge provenant d'un laser femotoseconde sont ensuite appliquées au fluide à une vitesse de 90 millions d'impulsions par seconde. Les nanoparticules de carbone absorbent la lumière, ce qui les rend chauds. Les particules chaudes chauffent ensuite le fluide environnant pour produire de la vapeur. La vapeur réagit avec les nanoparticules de carbone pour former de l'hydrogène et du monoxyde de carbone.
Les deux gaz forment une bulle qui grossit au fur et à mesure que le laser fournit de l'énergie. La bulle s'effondre soudainement lorsque le laser est éteint, créant une onde de choc qui perce des trous dans les membranes des cellules voisines. Les ouvertures permettent aux agents thérapeutiques du fluide environnant d'entrer dans les cellules. Les trous se ferment rapidement pour que la cellule puisse survivre.
Les chercheurs ont démontré qu'ils pouvaient obtenir la petite molécule de calcéine, la protéine d'albumine de sérum bovin et l'ADN plasmidique à travers les membranes cellulaires de cellules cancéreuses de la prostate humaine et de cellules de gliosarcome de rat en utilisant cette technique. L'absorption de calcéine a été observée dans 90 pour cent des cellules à des niveaux laser qui ont laissé plus de 90 pour cent des cellules en vie.
"Nous pourrions faire en sorte que presque toutes les cellules absorbent ces molécules qui normalement n'entreraient pas dans les cellules, et presque toutes les cellules sont restées vivantes, " dit Prerona Chakravarty, l'auteur principal de l'étude. "Notre système de nanoparticules de carbone activé par laser permet des implosions de bulles contrôlées qui peuvent perturber les membranes cellulaires juste assez pour faire entrer les molécules sans causer de dommages durables."
Pour évaluer combien de temps les trous dans la membrane cellulaire sont restés ouverts, les chercheurs ont laissé les thérapies simulées hors du fluide lorsque les cellules ont été exposées à la lumière laser, puis ajouté les agents une seconde après avoir éteint le laser. Ils n'ont vu presque aucune absorption des molécules, suggérant que les membranes cellulaires se sont refermées rapidement.
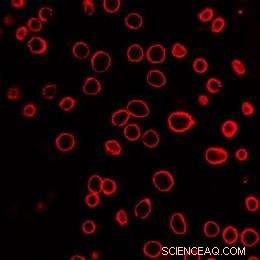
Un champ de cellules cancéreuses de la prostate humaine est montré après exposition à des nanoparticules de carbone activées par laser. Les membranes cellulaires ont été colorées en rouge pour faciliter la visualisation. Chacun des cercles rouges est une seule cellule. Crédit :Crédit :Prerona Chakravarty
Pour confirmer que la réaction carbone-vapeur était un facteur critique pour les nanoblastes, les chercheurs ont remplacé les nanoparticules de carbone par des nanoparticules d'or avant l'exposition à la lumière laser. Parce qu'ils manquaient du carbone nécessaire à la réaction, les nanoparticules d'or ont produit peu d'absorption des molécules, Prausnitz a noté.
De la même manière, les chercheurs ont substitué des nanotubes de carbone aux nanoparticules de carbone, et a également mesuré peu d'absorption, ce qu'ils ont expliqué en notant que les nanotubes sont moins réactifs que les particules de noir de carbone.
L'expérimentation a en outre montré que l'ADN introduit dans les cellules par la technique d'activation laser restait fonctionnel et capable de piloter l'expression des protéines. Lorsque l'ADN plasmidique codant pour l'expression de la luciférase a été introduit dans les cellules cancéreuses, la production de luciférase a été multipliée par 17.
Pour le futur, les chercheurs prévoient d'étudier l'utilisation d'un laser nanoseconde moins coûteux pour remplacer l'instrument femtoseconde ultrarapide utilisé dans la recherche. Ils prévoient également d'optimiser les nanoparticules de carbone afin que la quasi-totalité d'entre elles soient consommées lors de l'exposition à la lumière laser. Les restes de nanoparticules de carbone dans le corps ne devraient produire aucun effet nocif, bien que le corps puisse être incapable de les éliminer, Prausnitz a noté.
"Il s'agit de la première étude montrant la preuve du principe de l'activation au laser de nanoparticules de carbone réactives pour l'administration de médicaments et de gènes, " Il a dit. " Il y a un chemin considérable à parcourir avant que cela puisse être introduit dans la médecine, mais nous sommes optimistes quant au fait que cette approche peut finalement fournir une nouvelle alternative pour l'administration d'agents thérapeutiques dans les cellules de manière sûre et efficace. »