Que ce soit sous forme de givre ou de glaçon lisse et transparent, la glace adhère spontanément et même assez fortement à de nombreuses surfaces solides. Cependant, comme peut en témoigner toute personne imprudente ayant dérapé sur un trottoir en hiver, la glace peut aussi être très glissante. En fait, la glace peut être à la fois collante et glissant.
Cette polyvalence a longtemps intrigué les scientifiques. Pour commencer, ils tentent de percer le secret de la glissance de la glace depuis plus de 150 ans. Parmi eux se trouvent des physiciens célèbres tels que Lord Kelvin et Michael Faraday. Ce dernier, plus connu pour ses travaux en électromagnétisme, fut le premier à envisager la présence d'une fine couche d'eau liquide recouvrant la glace, même bien en dessous de 0°C. À l’époque, il pensait que le contact d’un objet solide contre la couche superficielle l’incitait à agir comme un lubrifiant, réduisant considérablement la friction sur la glace. L'existence de cette couche liquide a été confirmée par des expériences plus d'un siècle plus tard.
Pour répondre à la question « Pourquoi la glace est-elle glissante ? » nous devons d'abord comprendre comment cette fine couche d'eau liquide sur la surface gelée est née.
L'eau étant plus dense dans sa phase liquide que dans son état glacé, on a longtemps pensé que la fonte de la surface de la glace était liée à une surpression, due par exemple au poids du patineur sur la petite surface située en dessous d'elle ou à un excès de pression. ses patins. En comprimant davantage la glace, le patineur la ferait fondre, la rendant liquide et glissante.
D'autres pensent que la chaleur est libérée par friction lorsque l'objet se déplace sur la glace, provoquant la fonte de la surface. Tout comme lorsque vous vous frottez les mains pour les réchauffer, lorsque vous frottez un solide contre un autre, elles s'échauffent.
Cependant, ces deux mécanismes n’expliquent pas pourquoi la glace reste glissante en dessous de -20°C. À de telles températures, il faudrait une pression considérable, environ 500 fois supérieure à celle exercée par un patin à glace, pour le faire fondre.
Dans les années 1960, plus d’un siècle après Faraday, J.W. Telford et J.S. Turner a lentement tiré un fil à travers la glace "froide" (en dessous de -20°C) pour révéler qu'elle restait glissante jusqu'à -35°C, moment auquel la chaleur dégagée par la friction ne suffisait plus à faire fondre la glace.
Ce n'est qu'un siècle environ après l'intuition de Faraday que l'on a pu démontrer indirectement cette couche liquide, en mesurant les propriétés de la surface de la glace et non son volume, en l'occurrence ses propriétés d'absorption des vapeurs d'hydrocarbures, tout à fait comparables à celles de la glace. de l'eau liquide !
Les techniques de diffusion de protons ou de rayons X, habituellement utilisées pour étudier la structure des cristaux, ont permis d'estimer l'épaisseur entre une et plusieurs centaines de nanomètres. Certaines études ont même suggéré que cette épaisseur divergeait à mesure que la température s'approche de 0°C.
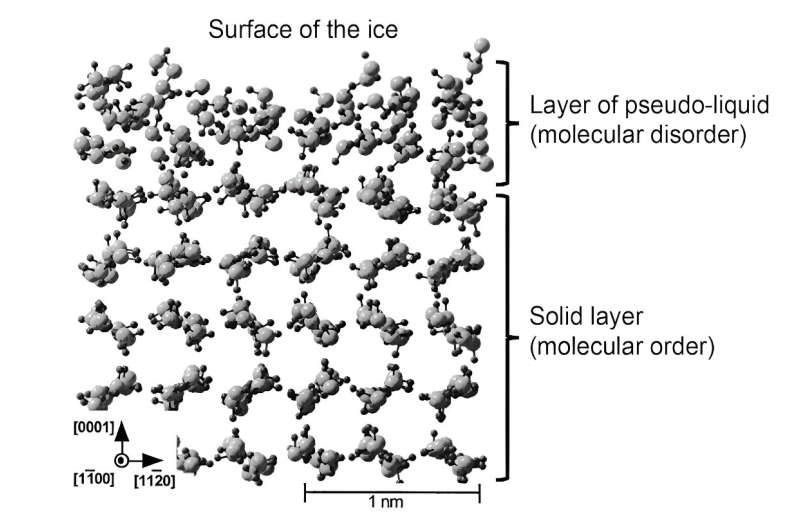
Plus récemment, des simulations ont permis de mieux représenter la structure de cette couche liquide. Par la suite, cette couche a été qualifiée de « pseudo-liquide » ou « quasi-liquide » pour la différencier de la véritable phase liquide. Ces travaux théoriques ont montré que dans cette couche superficielle, les molécules sont capables de se déplacer plus librement, confirmant ainsi son rôle de lubrifiant. Néanmoins, la structure moléculaire n'est pas exactement la même que celle de l'eau liquide, ce qui a des conséquences sur les propriétés mécaniques de cette couche pseudo-liquide.
Une étude récente a montré une forte corrélation entre la mobilité individuelle des molécules et le coefficient de frottement macroscopique (plus le coefficient est faible, plus il est facile de glisser), suggérant que ce n'est pas tant l'épaisseur de la couche qui compte pour le glissement. mais plutôt le mouvement individuel des molécules. La valeur minimale du coefficient de friction est mesurée à -7°C, connue comme la température optimale pour les skieurs et les patineurs.
D'autres recherches ont été menées au cœur de la couche pseudo-liquide à l'aide d'une nano-sonde, pointe d'un microscope à force atomique. En faisant vibrer cette pointe reliée à un capteur de force extrêmement précis, mesurant le frottement entre la pointe et le liquide de la couche, les auteurs ont mesuré que ce liquide peut être 50 fois plus visqueux que l'eau liquide, et qu'il possède également une élasticité (propriété plus associé à l’état solide). Cette viscosité est similaire à celle de vos huiles alimentaires, faisant de la couche pseudo-liquide un excellent lubrifiant.
En résumé :la glace glisse car une couche liquide d’environ 1 à 100 nanomètres d’épaisseur se forme à sa surface. Ses propriétés mécaniques (viscosité, élasticité), différentes de celles de l'eau liquide, et la mobilité des molécules qui la composent, bien supérieure à celle de la glace solide, lui confèrent ses propriétés lubrifiantes exceptionnelles.
La viscosité de la glace continue cependant de dérouter les scientifiques, malgré 70 ans d'expériences. Lors de ces dernières, les scientifiques ont eu tendance à utiliser un kit assez simple :un piston relié à un capteur de force pousse un bloc de glace, lui-même collé à un objet solide. Lorsque le glaçon se détache, la force enregistrée par le capteur devient brusquement nulle, et la valeur maximale avant cette rupture est mesurée. Mais ces résultats ont montré des tendances parfois contradictoires, et une dispersion assez large.
Une étude récente sur le sujet a conclu que la force d'adhésion de la glace « dépend non seulement de la composition chimique, de la rugosité de la surface, des propriétés mécaniques et thermiques du substrat [mais] dépend également de manière critique de la température et même du dispositif expérimental de mesure de l'adhésion. ."
Pour être un peu plus précis, lorsque l'on explore la littérature sur le sujet au cours des 60 dernières années, on constate que la force avec laquelle la glace adhère à un solide dépend fortement de la température comprise entre -20°C et 0°C ( la glace colle plus fort à un solide plus froid). Quant au rôle de la rugosité de surface, il est ambivalent :pour certains solides (notamment les métaux), la glace adhère plus fortement à un substrat plus rugueux, alors que sur certains plastiques c'est l'inverse…
Enfin, au niveau chimique, l’eau liquide peut mieux se répandre sur certaines surfaces que sur d’autres. Par exemple, l'eau s'étale très bien sur du verre propre, alors que certaines surfaces sont hydrophobes, comme le Téflon.
Une étude récente a démontré que plus l’eau à l’état liquide se répand à la surface d’un solide, plus la glace adhère à ce solide. À l'inverse, une surface ayant peu d'affinité pour l'eau liquide aura également peu d'adhérence pour la glace.
Pourquoi cette relation entre la propagation de l’eau et l’adhésion de la glace ? Premièrement, pour que la glace adhère à un solide froid, l’eau à l’état liquide doit pouvoir geler au contact du solide. Voici une expérience simple que tout le monde peut réaliser :
Que peut-on conclure ? Intuitivement, plus l'affinité de l'eau pour la surface est grande, plus l'eau liquide s'infiltre facilement dans les aspérités et les interstices de la surface du solide, augmentant ainsi la surface de contact entre celui-ci et la glace après solidification, consolidant ainsi l'adhésion. Cette expérience démontre également le rôle de l’eau liquide comme adhésif. Lorsque l'on utilise un adhésif classique, par exemple de la colle liquide, pour assembler deux pièces, c'est lorsque les pièces se solidifient (par évaporation d'un solvant présent dans la colle) que l'adhésion forte et définitive se produit. La même chose se produit lorsque l’eau liquide refroidit au contact d’un solide froid et se solidifie. La couche d'eau gelée joue alors le rôle d'un des solides.
Nous ne pouvons pas expliquer en détail l’adhérence de la glace, mais nous pouvons essayer de réduire sa force. L'idée d'utiliser des traitements déperlants a naturellement émergé, mais ces traitements sont peu robustes dans le temps et peuvent avoir l'effet inverse de celui escompté. Des solutions plus prometteuses consistent à étaler une fine couche d'huile ou d'hydrogel sur la surface, mais des problèmes subsistent quant à la stabilité de ces couches sur de grandes surfaces.
Une autre approche consiste à utiliser des méthodes de dégivrage actif. L'une de ces techniques est l'échographie de surface, qui génère des « micro-séismes » sur la surface solide et peut provoquer le bris de la glace. Nous étudions actuellement cette méthode au laboratoire MSC.
Fourni par The Conversation
Cet article est republié à partir de The Conversation sous une licence Creative Commons. Lisez l'article original. 