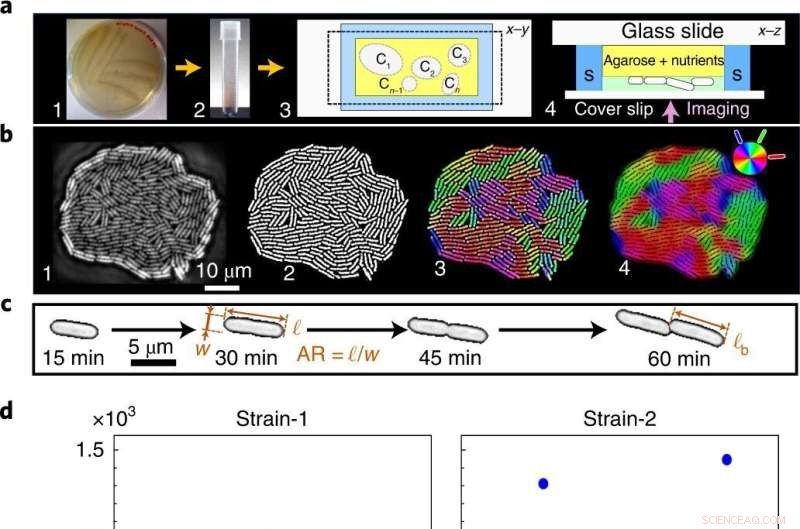
Des phénotypes bruyants à un événement de transition mono-multicouche statistiquement précis. un , Les cellules striées sur plaque de gélose riche en nutriments (1) sont transférées dans le milieu liquide (2), puis ensemencées au sein de la chambre microfluidique, ici Ci désigne des colonies individuelles (3), pour l'imagerie time-lapse en contraste de phase (4) dans la piscine (S). b , Les images brutes des colonies en croissance (1) sont binarisées pour extraire les traits phénotypiques (2) et codées par couleur pour visualiser l'orientation cellulaire locale (3,4). c , Traits géométriques unicellulaires :AR et ℓ b . j ,e , A c est indépendant de la température de croissance (d ), comme le révèlent à la fois notre théorie et nos expériences, alors que t c dépend de la température (e ). Les points bleus et rouges indiquent des réplicats biologiques distincts (y compris plusieurs réplicats techniques) pour A c et t c données expérimentales. A c a une grande variance sur tous les T , alors que t c a une faible variance, qui se minimise davantage avec la température de croissance. f , Bruit phénotypique spécifique au trait, quantifié comme la variance normalisée, F = var(⋯)/〈⋯〉 2 , sur T :ℓ b (carrés bleus), A c (triangles rouges), temps de doublement de la longueur de cellule τ sc (losanges noirs), AR (triangles magenta) et t c (cercles verts). Malgré le bruit phénotypique élevé à des échelles individuelles (ℓ b , AR et τ sc ), t c est statistiquement précis (le bruit correspondant est inférieur d'un ordre de grandeur sur tous les T ). La barre d'erreur indique l'écart type de F entre les colonies. Crédit :Physique de la nature (2022). DOI :10.1038/s41567-022-01641-9
Les bactéries collaborent et se coordonnent collectivement en formant une structure partagée appelée biofilm, comme la plaque dentaire sur nos dents ou le microbiome associé à notre intestin. Cette auto-organisation en plusieurs couches complexes - malgré les variations des propriétés cellulaires au niveau individuel - nécessite que les systèmes vivants partagent un temps commun mais précis, qui vient d'être découvert par des physiciens de l'Université du Luxembourg.
Le professeur Anupam Sengupta et son équipe ont expliqué cela en zoomant sur la croissance et le développement de biofilms bactériens naissants, dans lesquels ils découvrent des échanges croisés émergents entre les propriétés biophysiques qui permettent une synchronisation précise des transitions structurelles, topologiques et hydrodynamiques à l'échelle de la population. Les découvertes révolutionnaires apparaissent dans la récente édition de la revue Nature Physics .
Les biofilms bactériens se trouvent sur presque toutes les surfaces naturelles et artificielles que nous rencontrons. Ils sont cruciaux pour l'existence humaine :de ceux de l'intestin qui régulent notre bien-être physique à ceux qui régulent la progression des cancers et maintiennent notre écosystème en équilibre. Grâce aux mécanismes de rétroaction physico-chimiques exquis qui régissent leurs modes de vie prolifiques associés à la surface, les biofilms sont très résistants et peuvent coloniser divers systèmes.
Des recherches récentes sur une cellule unique menées par le professeur Sengupta et ses collaborateurs ont révélé les rôles essentiels que jouent la géométrie et la dynamique de croissance d'une seule cellule dans la formation des propriétés dynamiques des couches bactériennes en croissance. Pourtant, l'impact de la variabilité des statistiques au niveau cellulaire - un acteur totalement ignoré dans les modèles de matière vivante et active existants - sur les phénomènes collectifs émergents dans les biofilms bactériens est resté un défi, et donc largement inexploré.
Aujourd'hui, des chercheurs du groupe Physique de la matière vivante de l'Université du Luxembourg résolvent cette énigme de longue date :comment les biofilms - et les systèmes vivants en général - régulent le calendrier des événements clés du développement émergeant d'individus aux attributs hautement variables et dynamiques. En adoptant une approche interdisciplinaire quantitative pour espionner les biofilms bactériens naissants, l'équipe du professeur Sengupta fournit les fondements mécanistes de la façon dont les étapes de développement opportunes émergent collectivement en raison de l'autorégulation des traits au niveau cellulaire, qui interagissent pour atténuer chacun les effets bruyants des autres, permettant finalement une synchronisation précise des événements clés du développement.
Le travail plonge plus profondément dans la rationalisation des résultats, fournissant une image physiologiquement cohérente basée sur les exigences métaboliques au cours des premières étapes du développement du biofilm. Les résultats démontrent comment l'autorégulation du bruit phénotypique entraîne des transitions bien synchronisées dans la structure, la topologie et les flux actifs dans les colonies bactériennes, soulignant le rôle stratégique de la physique dans la compréhension des systèmes biologiques. Les travaux s'inscrivent largement dans l'initiative Physics Meets Biology au sein de l'Université du Luxembourg.
Les phénotypes bruyants entraînent des événements de développement au bon moment
Malgré la variabilité des traits phénotypiques, tels que la géométrie cellulaire, les taux de croissance et l'association de surface, les biofilms bactériens subissent des étapes de développement critiques dans leur cycle de vie à des moments précis, à commencer par la transition mono-multicouche (MTMT). Suite à cette transition structurelle clé, une cascade émergente est déclenchée, chronométrant de manière synchrone les changements de topologie et de champs d'écoulement actifs à l'intérieur et à proximité des biofilms naissants.
Le catalogue des traits phénotypiques clés chez Escherichia coli et Serratia marcescens poussant dans diverses conditions (niveaux de nutriments et températures), permettant un contrôle minutieux de l'activité biologique, et quantifie comment les échanges entre les bruits phénotypiques déterminent la rapidité de l'organisation structurelle et l'émergence de transport local actif. Ce travail établit ainsi le premier lien direct et mécaniste entre la variabilité au niveau cellulaire dépendante de l'activité et les propriétés émergentes à l'échelle de la population dans les systèmes vivants.
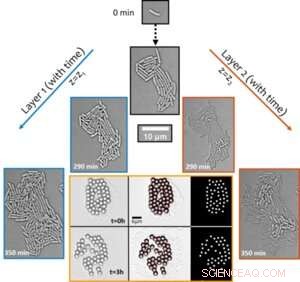
Figure 1. La transition structurelle des biofilms naissants de mono- à multi-couches entraîne le transport synchrone émergent autour de la colonie. Le phénomène de transport actif a été découvert en visualisant le déplacement de particules de la taille d'un micron au fil du temps (illustré dans l'image à six panneaux avec une bordure orange). Crédit :Université du Luxembourg
Tirer parti d'une approche inter-échelles et interdisciplinaire
En utilisant une combinaison d'imagerie unicellulaire en accéléré, de vélocimétrie par images de particules, de simulations numériques et de modélisation du continuum, l'équipe quantifie la variabilité au niveau cellulaire en termes de bruit phénotypique et découvre des compromis qui suppriment finalement la variabilité des propriétés émergentes et les rendent synchrone. Plus précisément, un compromis entre le bruit dans la géométrie cellulaire et le taux de croissance autorégule le moment de la transition mono-multicouche (MTMT), une étape clé dans l'initiation du biofilm, déclenchant une cascade hydrodynamique active synchrone qui entraîne finalement un transport local amélioré autour des colonies bactériennes confluentes.
Remarquablement, bien que l'espèce soit de nature non mobile, l'hydrodynamique active dépendante de la croissance au sein des colonies confluentes déclenche des flux locaux dans leur environnement qui sont suffisamment forts pour perturber les amas de particules auto-assemblées (utilisés comme traceurs, voir Figure 1) et les transporter. activement à travers l'environnement microbien. L'amélioration du transport - dans un cadre par ailleurs limité par la diffusion - de plus de deux ordres de grandeur suggère des fonctions biologiques de tels flux actifs dans le transport de molécules et de microcargaison au cours des premières étapes du développement du biofilm.
Ce travail présente une percée dans le domaine de la physique de la matière active microbienne et fournit un nouveau paradigme pour comprendre comment les populations bactériennes confluentes peuvent faire face aux variations environnementales, y compris celles imposées par le mode de vie et les changements climatiques, en tirant parti de leur variabilité à l'échelle individuelle.
Perspectives sur le transport actif synchrone dans les biofilms naissants
L'équipe démontre que les colonies sessiles peuvent générer et exploiter des flux actifs pour faire la navette entre des cargaisons biologiques de taille submicronique à micronique qui sont largement associées aux colonies bactériennes. Pris ensemble, les dimensions de portée de micro-cargaison associées allant de quelques dizaines de nanomètres à quelques microns. Les micro-cargaison typiques comprennent des cellules bactériennes (différentes espèces porteuses et de cargaison de taille micronique), des spores fongiques à l'échelle du micron ; des liposomes et des vésicules extracellulaires délivrant une charge génétique ou biochimique (taille de dizaines à centaines de nanomètres), des bactériophages auto-stop (des centaines de nanomètres) et des billes et capsules synthétiques pertinentes pour l'administration de médicaments (taille inférieure au micron à des dizaines de microns).
L'importance biologique du lien synchrone entre la structure, le flux et le transport est à plusieurs volets :la synchronisation stricte des événements d'extrusion présente le MTMT comme un proxy biophysique de la détection de type quorum entre les colonies, avec des ramifications potentielles de et dans la sélection synchrone pour cellules résistantes (par exemple, contre les antibiotiques). Perturber le calendrier MTMT bien défini (par exemple, en ajustant de manière appropriée les facteurs environnementaux) pourrait offrir de futures alternatives pour inhiber le quorum-sensing, et ainsi réguler la résistance bactérienne aux antibiotiques.
Pour l'avenir, il sera essentiel de comprendre comment les colonies sessiles exploitent le temps critique bien défini pour régler les communications inter-colonies dans des environnements stressants (dans l'espace des paramètres du bruit intrinsèque et de la synchronisation temporelle du flux de structure). Les phénomènes spatio-temporels induits par le bruit présentés dans ce travail fournissent des informations clés manquantes sur la biophysique du développement de la morphogenèse dans les systèmes de plus grande complexité, y compris les consortiums polymicrobiens observés dans les microbiomes humains et végétaux, et les systèmes de tissus multicellulaires pertinents pour l'embryon et le cancer. évolution.
Ces travaux ouvrent de nouvelles voies de recherche dans les domaines de la physique de la matière active microbienne, de la physique molle et biologique, de la biologie cellulaire, et, en raison du rôle important des biofilms bactériens dans le microbiome humain et l'écologie environnementale, également dans les sciences biomédicales et biotechnologiques. Les résultats topologiques structurels et multichamps présentés ici à travers la vision du professeur Sengupta seront conséquents pour divers systèmes confluents couvrant des systèmes actifs de tissus et de cellules, et un large éventail de modèles organoïdes.
Enfin, ce travail fournit un nouveau système de modèle expérimental pour la recherche sur la matière active où des entités passives coexistent avec des agents actifs, et inspirent une nouvelle classe de modèles théoriques qui intègrent la variabilité cellulaire et les compromis pour comprendre l'impact du bruit, un élément intrinsèque variable biophysique, sur les propriétés émergentes dans les systèmes vivants. Les chercheurs manipulent la démographie de la communauté bactérienne avec une nouvelle technologie électronique