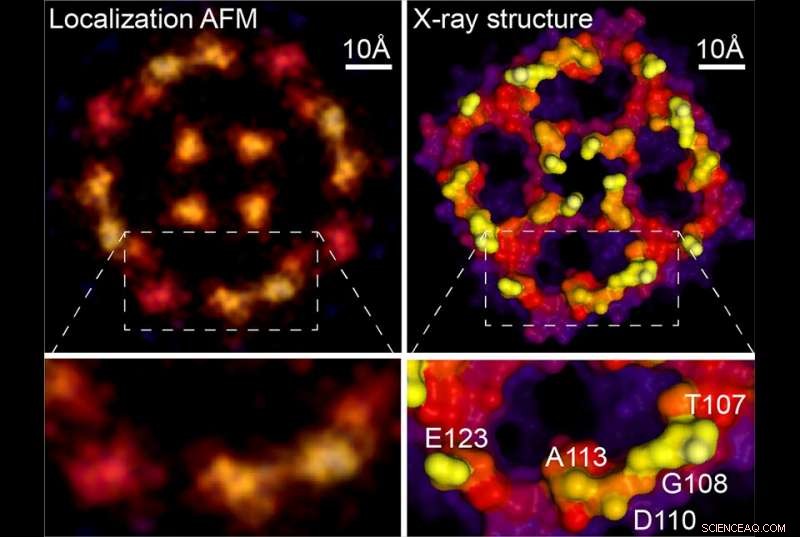
Localisation AFM &structure radiographique. Crédit :Weill Cornell Medicine, Université de Leeds et Université de Washington
Les scientifiques de Weill Cornell Medicine ont développé une technique informatique qui augmente considérablement la résolution de la microscopie à force atomique, un type spécialisé de microscope qui "sent" les atomes à une surface. La méthode révèle des détails au niveau atomique sur les protéines et autres structures biologiques dans des conditions physiologiques normales, ouvrant une nouvelle fenêtre sur la biologie cellulaire, virologie et autres processus microscopiques.
Dans une étude, publié le 16 juin dans La nature , les enquêteurs décrivent la nouvelle technique, qui est basé sur une stratégie utilisée pour améliorer la résolution en microscopie optique.
Pour étudier les protéines et autres biomolécules à haute résolution, les chercheurs se sont longtemps appuyés sur deux techniques :la cristallographie aux rayons X et la cryomicroscopie électronique. Alors que les deux méthodes peuvent déterminer les structures moléculaires jusqu'à la résolution des atomes individuels, ils le font sur des molécules qui sont soit échafaudées en cristaux, soit congelées à des températures ultra-froides, peut-être en les altérant par rapport à leurs formes physiologiques normales. La microscopie à force atomique (AFM) permet d'analyser des molécules biologiques dans des conditions physiologiques normales, mais les images résultantes sont floues et de faible résolution.
"La microscopie à force atomique peut facilement résoudre les atomes en physique, sur des surfaces solides de silicates et sur des semi-conducteurs, cela signifie donc qu'en principe la machine a la précision pour le faire, " a déclaré l'auteur principal, le Dr Simon Scheuring, professeur de physiologie et de biophysique en anesthésiologie à Weill Cornell Medicine. "La technique est un peu comme si vous deviez prendre un stylo et scruter les montagnes Rocheuses, afin que vous obteniez une carte topographique de l'objet. En réalité, notre stylo est une aiguille qui est acérée jusqu'à quelques atomes et les objets sont des molécules de protéine uniques."
Cependant, les molécules biologiques ont de nombreuses petites pièces qui se tortillent, brouiller leurs images AFM. Pour résoudre ce problème, Le Dr Scheuring et ses collègues ont adapté un concept de la microscopie optique appelé microscopie à super-résolution. "Théoriquement, il n'était pas possible par microscopie optique de résoudre deux molécules fluorescentes qui étaient plus proches que la moitié de la longueur d'onde de la lumière, " dit-il. Cependant, en stimulant la fluorescence des molécules adjacentes à des moments différents, les microscopistes peuvent analyser la propagation de chaque molécule et localiser leurs emplacements avec une grande précision.
Au lieu de stimuler la fluorescence, L'équipe du Dr Scheuring a noté que les fluctuations naturelles des molécules biologiques enregistrées au cours des analyses AFM produisent des écarts similaires de données de position. Premier auteur, le Dr George Heath, qui était associé postdoctoral à Weill Cornell Medicine au moment de l'étude et est maintenant membre du corps professoral de l'Université de Leeds, engagés dans des cycles d'expériences et de simulations informatiques pour comprendre plus en détail le processus d'imagerie AFM et extraire le maximum d'informations des interactions atomiques entre la pointe et l'échantillon.
En utilisant une méthode comme l'analyse de super-résolution, ils ont pu extraire des images à résolution beaucoup plus élevée des molécules en mouvement. Poursuivant l'analogie topographique, Le Dr Scheuring a expliqué que « si les roches (c'est-à-dire, atomes) se tortillent un peu de haut en bas, vous pouvez détecter celui-ci, puis celui-là, puis vous faites la moyenne de toutes les détections au fil du temps et vous recevez des informations haute résolution."
Étant donné que les études AFM précédentes ont systématiquement collecté les données nécessaires, la nouvelle technique peut être appliquée rétroactivement aux images floues que le champ a générées pendant des décennies. Par exemple, le nouvel article comprend une analyse d'un scan AFM d'une protéine membranaire d'aquaporine, acquis à l'origine pendant la thèse de doctorat du Dr Scheuring. La réanalyse a généré une image beaucoup plus nette qui correspond étroitement aux structures de cristallographie aux rayons X de la molécule. "Vous obtenez fondamentalement une résolution quasi-atomique sur ces surfaces maintenant, " a déclaré le Dr Scheuring. Pour montrer la puissance de la méthode, les auteurs fournissent de nouvelles données haute résolution sur l'annexine, une protéine impliquée dans la réparation de la membrane cellulaire, et sur un antiporteur de chlorure de proton dont ils rapportent également des changements structurels liés à son fonctionnement.
En plus de permettre aux chercheurs d'étudier des molécules biologiques dans des conditions physiologiquement pertinentes, la nouvelle méthode a d'autres avantages. Par exemple, La cristallographie aux rayons X et la cryomicroscopie électronique reposent sur la moyenne des données d'un grand nombre de molécules, mais l'AFM peut générer des images de molécules uniques. "Au lieu d'avoir des observations de centaines de molécules, nous observons une molécule cent fois et calculons une carte à haute résolution, " a déclaré le Dr Scheuring.
L'imagerie de molécules individuelles pendant qu'elles remplissent leurs fonctions pourrait ouvrir de tout nouveaux types d'analyse. « Disons que vous avez une protéine de pointe [virale] qui est dans une conformation, puis elle est activée et passe dans une autre conformation, " a déclaré le Dr Scheuring. " Vous seriez en principe capable de calculer une carte à haute résolution à partir de cette même molécule lors de son passage d'une conformation à l'autre, pas de milliers de molécules dans l'une ou l'autre conformation. » De telles données de molécule unique à haute résolution pourraient fournir des informations plus détaillées et éviter les résultats potentiellement trompeurs qui peuvent se produire lors de la moyenne des données de nombreuses molécules. De plus, la carte pourrait révéler de nouvelles stratégies pour rediriger ou interrompre précisément de tels processus.