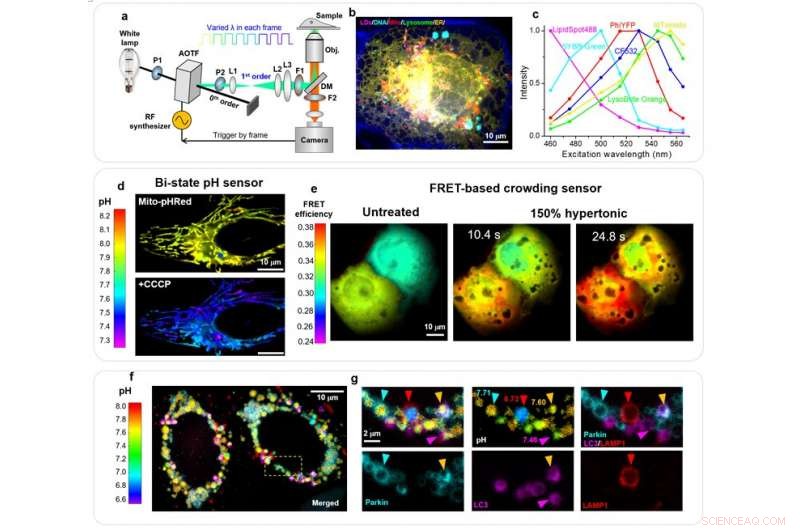
une, Schéma de l'installation. Des micrographies spectrales pleine trame sont obtenues par la modulation rapide synchronisée de la longueur d'onde d'excitation dans des trames consécutives. P, polariseur; L, lentille; F, filtre passe-bande; DM, miroir dichroïque. b, Images non mélangées de 6 cibles subcellulaires dans une cellule COS-7 vivante avec 8 longueurs d'onde d'excitation. LipidSpot 488 :gouttelettes lipidiques (LD), SYBR Green :ADN mitochondrial, Mito-PhiYFP :matrice mitochondriale, WGA-CF532 :membrane cellulaire, LysoBrite Orange :lysosomes, tdTomate-ER3 :ER. c, Spectres d'excitation de référence des 6 fluorophores, mesurés séparément sur l'installation à l'aide d'échantillons étiquetés individuellement. ré, Cartes de pH absolu mito-pHRed de la matrice mitochondriale dans une cellule HeLa vivante, avant (en haut) et après (en bas) un traitement de 120 s avec 20 M de CCCP. e, Cartes FRET codées par couleur pour un capteur d'encombrement macromoléculaire, pour deux cellules COS-7 vivantes avant (à gauche), ~10 s après (centre), et ~ 25 s après (à droite) un traitement hypertonique à 150 %. F, Images non mélangées de la carte de pH absolu Mito-pHRed à code couleur, mOrange2-Parkin, PhiYFP-LC3, et LAMP1-Clover pour deux cellules HeLa vivantes exprimant Parkin après l'application de 20 M de CCCP pendant 4 h. g, Zoom sur la case blanche en (f) Crédit :Kun Chen, Rui Yan, Limin Xiang, et Ke Xu
La capacité de multiplexage de la microscopie à fluorescence est sévèrement limitée par la large largeur spectrale de fluorescence. L'imagerie spectrale offre des solutions potentielles, pourtant, les approches typiques pour disperser les spectres d'émission locaux entravent notablement le débit atteignable et imposent des contraintes substantielles sur la résolution temporelle. Les filtres passe-bande accordables offrent la possibilité de balayer la longueur d'onde d'émission dans le champ large. Cependant, l'application de bandes passantes étroites à l'émission de fluorescence entraîne une utilisation inefficace du signal rare.
Dans un nouvel article publié dans Lumière :science et applications , une équipe de scientifiques, dirigé par le professeur Ke Xu du Collège de chimie, Université de Californie, Berkeley, Les États-Unis ont démontré qu'en utilisant un seul, bande de détection d'émission de fluorescence fixe, grâce à un balayage rapide synchronisé sur la trame de la longueur d'onde d'excitation d'une lampe blanche via un filtre accordable acousto-optique (AOTF), jusqu'à 6 cibles subcellulaires, marqué par des fluorophores communs de chevauchement spectral substantiel, peuvent être simultanément imagées dans des cellules vivantes avec une faible diaphonie (~ 1 %) et une résolution temporelle élevée (jusqu'à ~ 10 ms).
La capacité démontrée à quantifier les abondances de différents fluorophores dans le même échantillon en démixant les spectres d'excitation leur a ensuite permis de concevoir de nouveaux, schémas d'imagerie quantitative pour les biocapteurs fluorescents à deux états et FRET (Förster Resonance Energy Transfer) dans les cellules vivantes. Ils ont ainsi atteint des sensibilités élevées et des résolutions spatio-temporelles plein format pour quantifier le pH de la matrice mitochondriale et l'encombrement macromoléculaire intracellulaire. Ils ont ainsi dévoilé d'importantes hétérogénéités spatiales dans les deux paramètres, y compris des sauts soudains et spontanés du pH de la matrice mitochondriale accompagnés de changements spectaculaires de la forme mitochondriale. Ils ont en outre démontré, pour la première fois, le multiplexage de l'imagerie du pH absolu avec trois organites/protéines cibles supplémentaires pour élucider le complexe, Voie de la mitophagie médiée par Parkin.
« L'extension potentielle de notre approche à encore plus de fluorophores peut être obtenue en augmentant davantage le nombre de longueurs d'onde d'excitation ou en intégrant la dispersion d'émission. Alors que dans ce travail, nous nous sommes concentrés sur un système facile basé sur un microscope à épifluorescence à lampe, les capacités rapides d'imagerie multi-fluorophore et de biocapteur quantitative que nous avons démontrées ici devraient être facilement extensibles à d'autres systèmes, y compris la microscopie à fluorescence en nappe de lumière et la microscopie à illumination structurée", ont commenté les scientifiques.
Ensemble, ces résultats "dévoilent les opportunités exceptionnelles que la microscopie spectrale d'excitation offre pour l'imagerie de fluorescence hautement multiplexée. La perspective d'acquérir des images spectrales rapides en grand champ sans avoir besoin de dispersion de fluorescence ou de souci de la réponse spectrale du détecteur offre un potentiel énorme, " concluent les scientifiques.