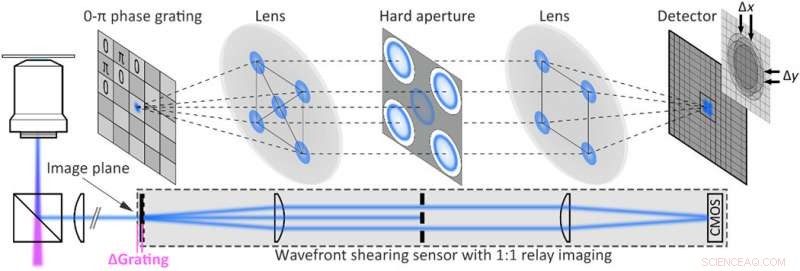
Mise en œuvre expérimentale de l'holographie de fluorescence monocoup. Configuration d'holographie à cisaillement de fluorescence obtenue en étendant un microscope à large champ à fluorescence avec un capteur de front d'onde composé d'un réseau de phase 2D 0-π et d'un système d'imagerie relais monté au port de sortie du microscope. L'ouverture dure bloque tous les ordres de diffraction sauf les premiers. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abc2508
Les biologistes utilisent couramment la microscopie à fluorescence en raison de la spécificité moléculaire et de la super-résolution de la technique. Cependant, la méthode est retenue par les limites d'imagerie. Dans un nouveau rapport sur Avancées scientifiques , Matz Liebel et une équipe de recherche de l'Institut des sciences et technologies de Barcelone et du Massachusetts General Hospital en Espagne et aux États-Unis ont signalé une approche d'imagerie pour récupérer le champ électrique complet de la lumière fluorescente en utilisant la sensibilité à une seule molécule. L'équipe a expérimenté le concept d'holographie numérique pour une détection rapide de la fluorescence en suivant la trajectoire tridimensionnelle (3-D) de nanoparticules individuelles à l'aide d'une résolution dans le plan de 15 nanomètres. En tant qu'applications biologiques de preuve de concept, les chercheurs ont imagé le mouvement 3D des vésicules extracellulaires à l'intérieur des cellules vivantes.
Nano livraison dans les tissus vivants
Dans ce travail, Liebel et al. développé une localisation de particules 3-D basée sur l'holographie de fluorescence à travers des vésicules extracellulaires à l'intérieur de cellules vivantes et observé des vésicules fortement confinées avec des périodes de transport actif. Assurer le transport de marchandises in vivo est actuellement un défi de taille, afin de mettre en œuvre activement des plateformes de nanomédecine mini-invasives. Les nanoparticules (NP) et les véhicules extracellulaires peuvent être conçus comme des candidats prometteurs pour être livrés en tant que véhicules, mais les scientifiques ne comprennent pas encore le parcours précis de ces dispositifs dans les tissus vivants.
Pour surmonter ces défis, ils doivent développer des méthodes d'imagerie monoparticulaire tridimensionnelle (3D) à grand champ pour suivre les particules individuelles simultanément pendant qu'elles se déplacent vers leur destination prévue. Les équipes de recherche avaient auparavant mis en œuvre des approches holographiques de la microscopie, bien que l'incohérence de la lumière fluorescente ne soit pas bien adaptée aux cellules vivantes ou à l'imagerie d'une molécule unique. En comparaison, L'interférométrie par cisaillement est une méthode prometteuse pour réaliser un enregistrement unique de processus dynamiques. L'idée sous-jacente derrière l'interférométrie à cisaillement comprend l'auto-interférence pour accéder aux gradients de phase jusqu'à un niveau de photon unique pour obtenir une holographie de fluorescence à un seul coup. Les mécanismes développés dans ce travail servent donc à observer la translocation intracellulaire à des échelles de longueur micrométriques pour fournir aux biologistes une meilleure compréhension des mécanismes intracellulaires.

Flux de travail de reconstruction de champ électrique. (A) Image obtenue expérimentalement de billes fluorescentes de 200 nm hors foyer montrant une modulation spatiale induite par le cisaillement des fonctions d'étalement des points (PSF). (B) La transformation de Fourier rapide (FFT) de (A) permet d'isoler les termes d'interférence d'intérêt à la fois dans les dimensions x et y au moyen d'une isolation d'ouverture dure et d'un passage à une fréquence nulle. (C) La transformation de Fourier rapide inverse (iFFT) des termes isolés de (B) donne les gradients de phase souhaités. (D) L'intégration analytique 2D avec un solveur de Poisson donne l'image de phase brute. (E) Mise à l'échelle des phases, pour tenir compte de la distance entre le réseau et la puce de la caméra, suivi d'une correction d'aberration dans les images finales de phase et d'amplitude. Toutes les barres d'échelle sont identiques, et l'enveloppement de phase 0-2π est uniquement à des fins de visualisation ; les informations non emballées sont directement obtenues. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abc2508
Principe d'imagerie et validation du système pour le suivi des particules en 3D
L'équipe a utilisé un microscope à fluorescence à grand champ avec un capteur de cisaillement de front d'onde composé d'un système d'imagerie à relais. La géométrie de l'installation a permis de mesurer des gradients de phase non nuls et a permis à Liebel et al. pour effectuer une auto-interférence à photon unique sur une image entière. L'équipe a imagé des billes de polystyrène fluorescentes sous forme de particules de 200 nm hors foyer et a extrait les informations d'intensité en tant que module d'argument des images filtrées pour l'extraction par gradient de phase. Après avoir observé le champ électrique complet, ils ont utilisé l'optique de Fourier pour corriger les aberrations complexes induites par la diffusion ou construire des images sur n'importe quel plan de leur choix. L'équipe s'est concentrée sur des expériences de localisation 3D nécessitant la récupération de la position précise d'un émetteur d'intérêt dans toutes les dimensions, y compris le plan Z. Les efforts de focalisation informatique ont indiqué la capacité précise de déterminer la position 3-D de plusieurs particules fluorescentes à diffusion libre.
Test de la trajectoire de focalisation computationnelle
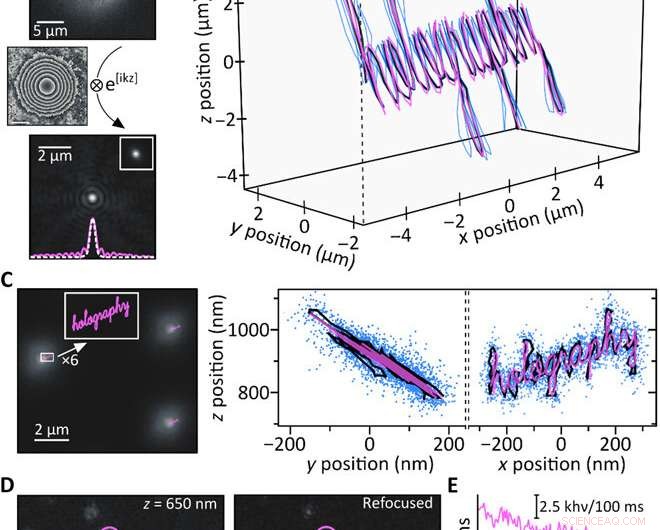
Expériences de preuve de concept. (A) Une perle fluorescente de 200 nm enregistrée à 4,4 um au-dessus de la mise au point (en haut) est refocalisée par calcul (en bas). L'encart montre une image au point obtenue expérimentalement de la même particule à côté d'une coupe à travers les PSF respectifs (en pointillés blancs :au point ; rose, solide :recentré). (B) Suivi 3D simultané de trois billes fluorescentes de 200 nm en déplaçant l'échantillon avec une platine piézo le long d'une trajectoire connue (rose :mouvement piézo; bleu :trajectoires reconstruites de billes individuelles; noir :trajectoire moyenne). Les trajectoires individuelles sont superposées en x/y pour plus de clarté; z =0 m correspond à une particule étant au foyer. (C) Trajectoires piézoélectriques limitées à la sous-diffraction (rose) par rapport à une image typique obtenue à 900 nm au-dessus du foyer (à gauche). Les projections de trajectoire moyenne y/z et x/z résultantes (noir) s'accordent bien avec la trajectoire piézo (rose), et les points bleus montrent toutes les positions obtenues en suivant simultanément 17 billes fluorescentes individuelles (à droite). L'analyse par histogramme des précisions de localisation donne σx/σy =15 nm et σz =21,5 nm, respectivement (note S7). (D) Les molécules ATTO647N uniques enregistrées hors foyer (à gauche) sont focalisées avec succès sur le plan informatique (au milieu). Les zones représentatives d'émission de fluorescence (rose, violet, et bleu) montrent le photoblanchiment en une étape comme prévu pour les émetteurs uniques. (E) traces de temps de photoblanchiment des trois régions mises en évidence en (D); la ligne pointillée indique le niveau de fond. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abc2508
Pour tester le raisonnement informatique derrière la configuration, Liebel et al. généré une trajectoire 3D connue et déplacé un échantillon contenant des billes fluorescentes immobilisées tout en enregistrant des images le long du chemin. Ils ont récupéré les informations de phase et d'amplitude et déterminé les positions 3-D des particules individuelles en utilisant la propagation numérique. Pour quantifier la plage Z accessible, ils ont défocalisé expérimentalement des particules individuelles, puis refocalisé informatiquement les images pour obtenir des mesures sans artefact sur une plage Z d'environ huit µm. Il est important d'assurer une localisation précise à l'échelle nanométrique à des échelles micrométriques en 3D pour imager les particules nanométriques diffusantes. L'holographie par fluorescence a répondu à ces exigences. Comme preuve de concept, les scientifiques ont imagé le mot "holographie, " où chaque lettre individuelle d'entrée mesurait moins de 50 nm de largeur pour obtenir une sortie bien résolue, confirmant la capacité de super-résolution de l'holographie fluorescente.
Imagerie de molécule unique et absorption cellulaire de nanoparticules
L'équipe a montré comment l'holographie par fluorescence fonctionnait dans des conditions de super-résolution biologiquement importantes en mesurant un échantillon composé de molécules individuelles. Malgré des intensités de fluorescence nettement réduites dans le montage expérimental, l'équipe a obtenu une focalisation informatique jusqu'à la limite de diffraction même pour des niveaux de photons aussi bas que 10 4 photons. Ils ont visualisé le trafic intracellulaire de nanoparticules inorganiques et de vésicules extracellulaires à l'aide du système. En tant que système modèle, ils ont utilisé des nanotiges d'or marquées par fluorescence qui sont inertes et donc sans interférence avec les fonctions cellulaires pour s'accumuler dans le cytoplasme, comme vérifié à l'aide d'images en fond noir de cellules vivantes. L'équipe a suivi les trajectoires des particules en enregistrant des images de fluorescence en time-lapse et en a extrait les termes de phase et d'amplitude. Les fonctions d'étalement de points (PSF) très variables ont indiqué la présence de nanotiges à différentes positions Z par rapport au plan focal.

Suivi de fluorescence 3D dans des cellules vivantes. (A) Expérience typique de suivi d'une seule particule de cellules vivantes. (B) Images de fluorescence saturée (rose) superposées sur des images correspondantes en champ clair de cellules rénales de singe. (C) Amplitude de fluorescence (à gauche) et phase (à droite) obtenues par imagerie de l'échantillon de cellules B. Tous les films sont enregistrés avec un temps d'exposition de 100 ms sur un total de 100 images à un cycle d'utilisation d'imagerie de 1/20 pour permettre à long terme imagerie. Pour tenir compte des grandes différences de luminosité entre les particules au foyer et hors foyer, nous affichons l'amplitude normalisée plutôt que l'intensité de fluorescence et plafonné l'échelle à 0,5 avec le maximum étant à 1. Encarts :original, déballé, des images de phase mettant en évidence la courbure convexe/concave des particules au-dessus/au-dessous du plan focal de l'image. (D) Comparaisons des segments d'image d'amplitude d'origine obtenus à partir de (C) avec des images obtenues par propagation informatique de -2 m (en haut) et 2 m (en bas). (E) Trajectoires 3D obtenues par holographie de fluorescence pour des particules diffusant à l'intérieur de cellules vivantes. Chaque trajectoire individuelle a une barre d'échelle individuelle, et la position z est codée par couleur. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abc2508
L'équipe a effectué une localisation en 3D de chaque nanotige dans la cellule et a reconstruit les trajectoires des particules sur 100 cadres d'observation pour obtenir six catégories représentatives, où certaines particules étaient immobiles pendant les 200 secondes d'observation, tandis que d'autres diffusent librement sur plusieurs micromètres. Les particules restantes présentaient à la fois des états liés et diffusants. De cette façon, la méthode d'holographie par fluorescence sous-jacente pourrait déterminer avec précision les positions 3D.
Absorption cellulaire et transport actif des vésicules extracellulaires
Liebel et al. ont ensuite étudié le transport actif en 3D de vésicules extracellulaires (VE) à l'intérieur de cellules vivantes en incubant des cellules HeLa avec des VE marqués par fluorescence. Ils ont acquis des hologrammes fluorescents toutes les quatre secondes pour reconstruire les trajectoires 3D de véhicules électriques individuels grâce à une combinaison de trajectoires automatisées et manuelles, reliant les positions 3-D EV. Liebel et al. des projections d'amplitude time-lapse superposées d'hologrammes fluorescents avec des images en champ clair enregistrées simultanément de cellules individuelles, pour montrer comment la plupart des véhicules électriques étaient localisés au bord des cellules adhérentes. Les observations et les calculs ont suggéré que les véhicules électriques étaient piégés à l'intérieur d'une zone, confiner leur mouvement à un volume spécifique; appartenant probablement au cytosquelette cellulaire.
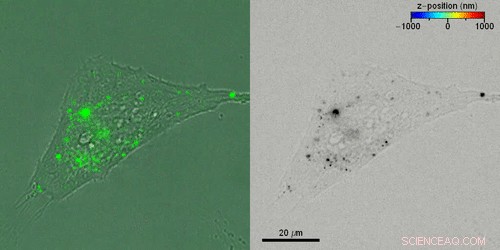
Reconstruire les trajectoires 3-D de vésicules extracellulaires (VE) individuelles à l'intérieur de cellules vivantes. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abc2508
Perspectives
De cette façon, Matz Liebel et ses collègues ont mis au point une méthode d'holographie par fluorescence à un seul coup à grand champ de vision pour permettre un suivi 3-D d'une seule particule sur une plage Z d'environ huit micromètres. Pour prouver ce concept, l'équipe a mis en œuvre une configuration expérimentale simple avec un débit de photons optimisé. Les fonctionnalités optimisées ont permis à l'holographie de fluorescence d'être une approche idéale pour étudier le suivi des particules en temps réel. L'équipe a montré un suivi de particule unique en 3D et observé le mouvement d'objets à l'échelle nanométrique dans des cellules vivantes, tels que les nanotiges d'or marquées par fluorescence et les véhicules électriques (vésicules extracellulaires). Alors que les nanotiges d'or ne se sont agrégées que dans le cytoplasme sans internalisation dans le noyau, les véhicules électriques se sont accumulés aux bords des cellules adhérentes dans un effet d'encombrement. Liebel et al. attendez-vous à effectuer une coloration supplémentaire pour identifier le cytosquelette intracellulaire, reliant ainsi l'architecture intracellulaire au mouvement des vésicules extracellulaires. Ces efforts mettront en lumière les mécanismes précis du transport de marchandises et de l'internalisation des particules à l'intérieur des cellules avec des applications importantes en nanomédecine pour répondre à des questions critiques en biologie et en médecine. Le mécanisme est également adapté pour mener d'autres méthodes d'imagerie volumétrique pour suivre l'intérieur des tissus et pour l'imagerie biochimique du calcium.
© 2020 Réseau Science X