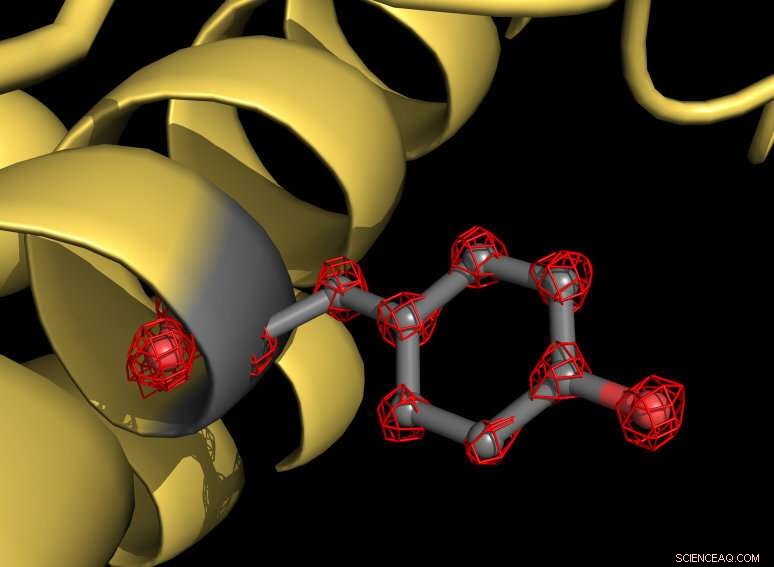
Une partie de la protéine apoferritine (jaune) avec une chaîne latérale de tyrosine surlignée en gris. L'acide aminé tyrosine se compose de plusieurs atomes qui sont individuellement reconnaissables dans la structure (structures en grille rouge). Crédit :MPI f. Chimie biophysique/ Holger Stark
Holger Stark de l'Institut Max Planck de chimie biophysique de Göttingen et son équipe ont franchi une barrière de résolution cruciale en cryomicroscopie électronique. Pour la première fois, son groupe a réussi à observer des atomes individuels dans une structure protéique et à prendre les images les plus nettes jamais réalisées avec cette méthode. Ces informations détaillées permettent de comprendre plus facilement comment les protéines font leur travail ou provoquent des maladies dans la cellule vivante. La technique pourra également être utilisée à l'avenir pour développer de nouveaux médicaments.
Depuis le début de la pandémie de COVID-19, des scientifiques du monde entier ont résolu les structures 3-D d'importantes protéines clés du nouveau coronavirus. Leur objectif commun est de trouver des sites d'accueil pour un composé actif capable de lutter efficacement contre l'agent pathogène.
Une méthode appliquée pour cela est la cryomicroscopie électronique (cryo-EM), qui peut être utilisé pour rendre visibles des structures tridimensionnelles de biomolécules. Comme ceux-ci sont structurellement très flexibles, ce n'est pas une tâche facile. Pour capturer les molécules floues sans les endommager, ils sont refroidis extrêmement rapidement, ou gelé par les chocs pour ainsi dire. Les échantillons congelés sont ensuite bombardés d'électrons, et les images résultantes sont enregistrées. En utilisant ceux-ci, la structure tridimensionnelle des molécules peut alors être calculée. Trois pionniers de cette technique, Jacques Dubochet, Joachim Franck, et Richard Henderson, a reçu le prix Nobel de chimie pour le développement de la cryo-EM en 2017.
Le record du monde de résolution permet de voir les atomes individuels dans les protéines
Le groupe de Stark a maintenant franchi la barrière de la résolution cryo-EM avec un microscope électronique cryo unique nouvellement développé par cette équipe. "Nous avons équipé notre appareil de deux éléments électron-optiques supplémentaires pour améliorer encore la qualité et la résolution de l'image. Ceux-ci garantissent que les erreurs d'imagerie des lentilles optiques, soi-disant aberrations, ne joue plus aucun rôle, " explique le directeur Max Planck. Son doctorant Ka Man Yip ajoute :" Les microscopes électroniques sont des instruments optiques et ressemblent physiquement à une caméra. Les aberrations d'un microscope électronique interfèrent en cryo-EM de la même manière que celles d'un appareil photo en photographie. Pour une qualité d'image nettement améliorée, il était donc crucial d'éviter ces erreurs d'aberration."
À l'aide du nouveau microscope, les scientifiques ont pris plus d'un million d'images de la protéine apoferritine pour cartographier la structure moléculaire avec une résolution de 1,25 angström. Un angström équivaut à un dixième de millionième de millimètre. « Nous visualisons maintenant des atomes uniques dans la protéine, une étape importante dans notre domaine, " explique le biologiste structurel Stark. " Pour nous, c'était comme mettre des super lunettes sur le microscope. La nouvelle structure révèle des détails jamais vus auparavant :nous pouvons même voir la densité des atomes d'hydrogène et des modifications chimiques d'un seul atome. »
Le grand potentiel de la cryo-EM pour l'imagerie de structures protéiques 3D haute résolution a également été démontré par des collègues du Medical Research Council Laboratory of Molecular Biology à Cambridge (Royaume-Uni). Ils ont atteint une résolution tout aussi élevée en utilisant une approche différente. "Il est maintenant concevable que la cryo-EM soit à l'avenir capable d'atteindre même des résolutions subatomiques, ", explique le chercheur.
Base de la conception de médicaments basée sur la structure
Mais quel est l'avantage de pouvoir étudier une structure de protéine avec une résolution atomique sans précédent ? Pour comprendre comment fonctionne une machine artificielle, il faut observer ses composants directement au travail. C'est également vrai pour les protéines, les nanomachines des cellules vivantes. Pour avoir une idée de la façon dont ils accomplissent leurs tâches, il faut connaître la position exacte de tous les atomes de la protéine.
Ces informations détaillées sont également pertinentes pour la conception de médicaments basés sur la structure. Les composés pour médicaments sont personnalisés de manière à se lier aux protéines virales, par exemple, et bloquer leur fonction. Mais quel est le mécanisme sous-jacent de l'inhibition ? Les chercheurs ne peuvent élucider et comprendre cela que s'ils peuvent observer au niveau atomique comment un composé et une protéine virale interagissent. Ces nouvelles connaissances aident à améliorer les molécules pour les médicaments et à réduire les effets secondaires. « En brisant cette barrière de résolution cryo-EM, la technique a atteint un niveau où les bénéfices pour les développements pharmaceutiques sont directement visibles, " dit Stark.