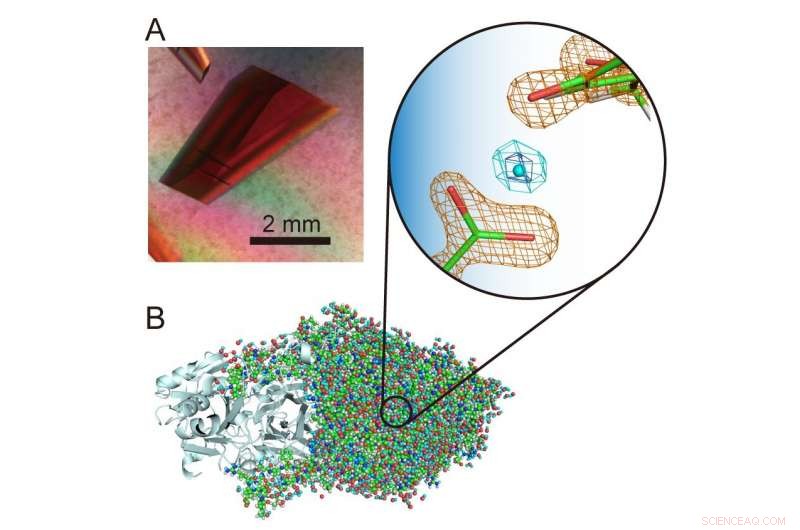
(A) Cristal extra-large d'une amine oxydase de cuivre. (B) Structure tridimensionnelle de l'amine de cuivre oxydase comprenant des atomes d'hydrogène. Un proton inhabituel "en lévitation" est présenté au centre de la vue agrandie. Crédit :Université d'Osaka
Comprendre le comportement des protéines et des enzymes est essentiel pour percer les secrets des processus biologiques. Les structures atomiques des protéines sont généralement étudiées par cristallographie aux rayons X; cependant, les informations précises sur les atomes d'hydrogène et les protons (ions hydrogène) sont généralement inaccessibles. Maintenant une équipe comprenant l'Université d'Osaka, Faculté de médecine d'Osaka, Instituts nationaux des sciences et technologies quantiques et radiologiques, Université d'Ibaraki, et l'Université de Tsukuba a utilisé la cristallographie neutronique pour révéler les détails structurels à haute résolution d'une très grande protéine oxydase. Leurs conclusions sont publiées dans PNAS .
Les atomes d'hydrogène et les protons qui constituent environ la moitié des atomes dans les protéines et les enzymes jouent souvent un rôle crucial dans les fonctions de ces biomolécules; cependant, leurs positions exactes sont difficiles à déterminer en raison de leur petite taille. L'approche la plus courante pour déterminer la structure d'une protéine est de diriger un faisceau de rayons X à haute énergie sur un cristal de protéine et d'analyser le diagramme de diffraction qui résulte des interactions des rayons X avec les électrons des atomes dans le structure. Malheureusement, Les rayons X n'interagissent pas fortement avec les atomes d'hydrogène ou les protons, qui ont une densité électronique faible ou nulle, ce qui les rend difficiles à "voir".
Une solution consiste à appliquer un faisceau de neutrons au cristal au lieu de rayons X. Les neutrons interagissent avec les noyaux des atomes sur leur chemin, y compris ceux des atomes d'hydrogène et des protons, malgré leur petite taille. Les diagrammes de diffraction résultant de ces interactions sont enregistrés après le passage du faisceau de neutrons à travers le cristal, et sont décodés dans les emplacements précis des noyaux, y compris les noyaux d'hydrogène.
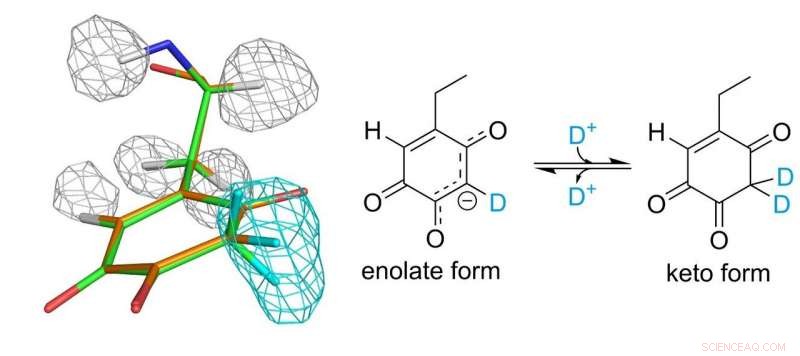
Structure du cofacteur topa quinone. Les mailles grises et bleu clair représentent les densités d'atomes d'hydrogène et de deutérium, respectivement. Crédit :Université d'Osaka
« Les atomes d'hydrogène et les protons sont des composants particulièrement intéressants des structures enzymatiques car ils peuvent présenter des comportements quantiques qui se sont récemment révélés cruciaux pour la fonction enzymatique. Il est donc important de déterminer avec précision leurs emplacements dans la structure des protéines afin de comprendre ce qui se passe. , ", explique l'auteur correspondant de l'étude Toshihide Okajima. "En utilisant la cristallographie neutronique, nous avons pu déterminer la structure d'une amine de cuivre oxydase bactérienne d'un poids moléculaire de 70, 600 - ce qui est extrêmement important pour la cristallographie neutronique et dépasse considérablement les masses moléculaires précédemment enregistrées - et localise toujours avec précision les atomes d'hydrogène et les protons dans la structure. Un proton inhabituel « en lévitation » a été observé entre un cofacteur, topa quinone, et un résidu d'acide aminé strictement conservé dans cette classe d'enzymes."
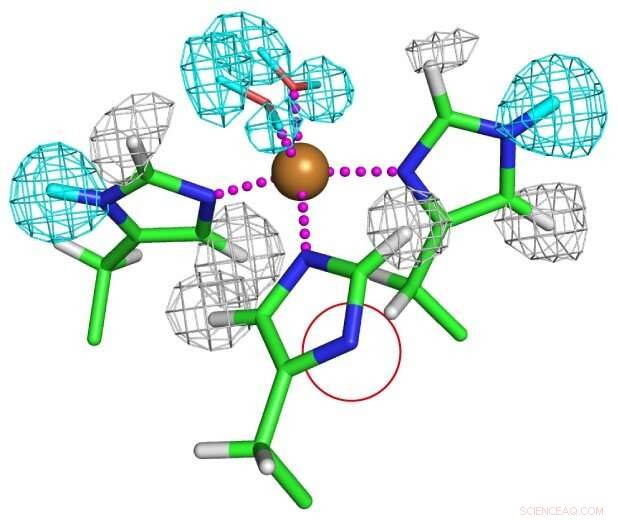
État de protonation des résidus d'histidine coordonnés au cuivre. L'un des résidus histidine est complètement déprotoné comme indiqué dans un cercle rouge pour former un anion imidazolate inhabituel. Crédit :Université d'Osaka
Le cofacteur topa quinone lié de manière covalente à l'enzyme joue un rôle essentiel dans la fonction catalytique. Les chercheurs ont finalement pu établir une image complète de la topa quinone 30 ans après sa découverte en tant que cofacteur dérivé des protéines. Ils ont découvert que le cofacteur existe réellement en équilibre entre deux formes différentes.
« Les sites actifs d'enzymes, où les réactions ont lieu, peuvent nous fournir beaucoup d'informations et d'inspiration si nous sommes capables de comprendre pleinement ce qui se passe, " explique Okajima. " Notre démonstration de l'utilisation de la cristallographie neutronique pour découvrir les effets quantiques des protons promet d'être très utile pour de nombreux chercheurs étudiant les enzymes et leurs mécanismes. "