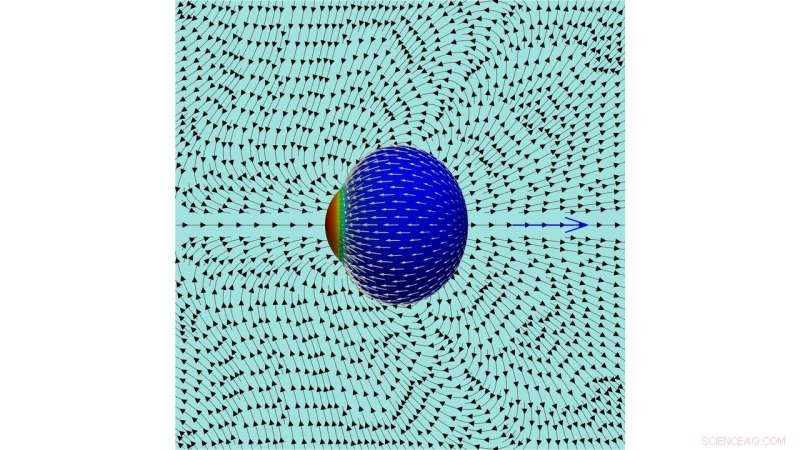
Une image des lignes de courant dans le fluide externe créé par une cellule en mouvement. Crédit :Farutin et al.
Motilité cellulaire, le mouvement spontané de cellules d'un endroit à un autre, joue un rôle fondamental dans de nombreux processus biologiques, y compris les réponses immunitaires et les métastases. Des études de physique récentes ont rassemblé de nouvelles preuves suggérant que les cellules de mammifères ne rampent pas seulement sur des substrats solides, y compris les supports 3-D complexes d'un tissu, mais peut aussi nager dans les fluides.
Dans une étude récente, une équipe de chercheurs de l'Université Grenoble Alpes et du CNRS (Centre National de la Recherche Scientifique) a tenté de faire la lumière sur les mécanismes à l'origine de l'apparition de la motilité des cellules en suspension, ce qui se produirait s'ils se déplaçaient dans des fluides. Leur papier, Publié dans Lettres d'examen physique , présente un modèle qui couple la cinétique de l'actine et de la myosine avec l'écoulement du fluide, qu'ils ont appliqués à une forme sphérique et une forme non sphérique.
"Des études récentes ont suggéré que l'adhésion n'est pas nécessaire pour que les cellules se déplacent dans un environnement tridimensionnel, et ont même montré que les cellules du système immunitaire peuvent nager lorsqu'elles sont en suspension dans un liquide, " les chercheurs qui ont mené l'étude ont déclaré à Phys.org par e-mail.
Le mouvement d'une cellule à travers un tissu pourrait être, au moins dans une certaine mesure, par rapport à son mouvement de nage dans un gel composé de filaments de collagène et de liquide interstitiel. Ce mouvement de nage particulier, cependant, rend les cellules quelque peu autonomes d'un substrat, leur permettant de naviguer à travers n'importe quel organe sans avoir à s'adapter à l'alternance de ligands extracellulaires, ce qui serait plutôt nécessaire pour ramper sur un substrat solide.
L'équipe de l'Université Grenoble Alpes a voulu montrer que les cellules peuvent nager dans un fluide en utilisant les mêmes mécanismes ou des mécanismes très similaires qu'elles utilisent lorsqu'elles rampent sur un solide. En outre, ils ont souhaité étudier l'origine de cette motilité et découvrir la rétroaction fournie par le milieu externe aux processus cellulaires internes.
"Bien que nous ayons collaboré étroitement avec plusieurs expérimentateurs pour développer notre compréhension du problème et collecté des ordres de grandeur pertinents des quantités physiques que nous manipulons, notre approche était principalement théorique pour cet article, et motivé par l'observation que les cellules doivent naviguer efficacement au lieu d'être liées à un substrat (c'est-à-dire, rampant), ", ont déclaré les chercheurs.
Le cytoplasme des cellules contient des protéines appelées actines et myosines. Avant qu'une cellule ne commence réellement à se déplacer d'un endroit à un autre, les molécules d'actine s'auto-assemblent en réseau le long de la membrane cellulaire, connu sous le nom de "cortex".
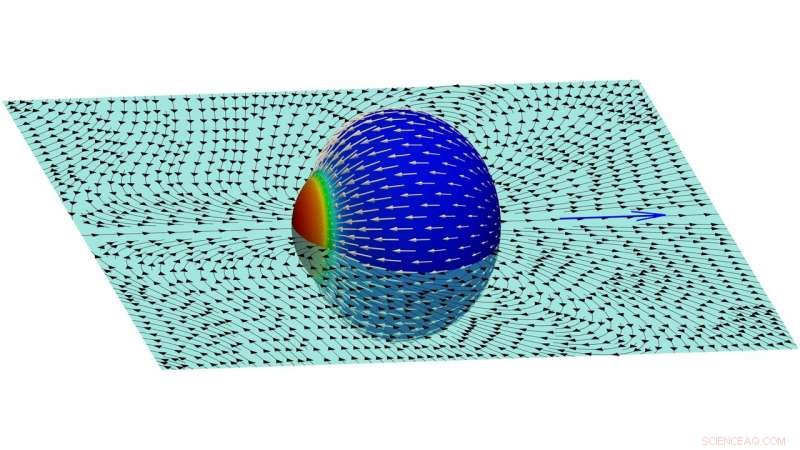
Une image des lignes de courant dans le fluide externe créé par une cellule en mouvement. Crédit :Farutin et al.
Le modèle cellulaire conçu par les chercheurs comporte deux composants clés :un gel de cortex d'actine et des moteurs de myosine. Les moteurs de myosine contractent le gel d'actine, créant finalement un flux de protéines d'actine et de myosine vers les zones à forte concentration de myosine. Finalement, il en résulte que toute la myosine est concentrée en un seul point, avec de l'actine qui coule vers elle.
"Ce flux continue perpétuellement, parce que de nouvelles molécules d'actine sont ajoutées à l'extrémité opposée de la cellule, " les chercheurs ont expliqué. " Nous avons montré que la cellule acquiert une polarité spontanée (c'est-à-dire, les molécules d'actine sont ajoutées à un pôle et retirées à l'autre extrémité, de manière durable). Le flux d'actine le long de la membrane saisit le fluide à l'extérieur pour réaliser la propulsion cellulaire et produit un schéma d'écoulement complexe dans le fluide environnant."
Les chercheurs ont observé que dans ce scénario, la vitesse de nage d'une cellule ressemble à la vitesse à laquelle on s'attendrait si elle rampait sur un substrat. C'est un peu surprenant, car la marche est généralement plus facile que la natation pour les organismes vivants. Selon les chercheurs, ceci pourrait s'expliquer par le fait que toute la surface de la cellule nageuse participe de manière concertée à la propulsion.
« En fonction du renouvellement et de la contractilité du cortex cellulaire (deux propriétés actives qui peuvent être contrôlées par la cellule soit génétiquement, soit par des voies biologiques spécifiques), nous avons découvert qu'une cellule peut spontanément se polariser et commencer à se déplacer dans un fluide, ", ont déclaré les chercheurs. "Il est également possible d'obtenir un comportement oscillatoire où la cellule change périodiquement de direction."
L'étude offre de nouvelles perspectives fascinantes sur les mécanismes à l'origine de la motilité natatoire des cellules, ou, comme le disent les chercheurs, leur capacité à ramper dans un fluide. Leurs observations pourraient être particulièrement utiles aux biologistes qui tentent de comprendre le mouvement des cellules, car ils impliquent qu'une cellule individuelle peut se déplacer de manière robuste à la fois dans un fluide et le long d'un substrat solide, utilisant les mêmes mécanismes.
Il est maintenant connu que les cellules immunitaires et les cellules métastatiques sont confrontées à des environnements très différents lorsqu'elles migrent au sein d'un organisme, Pourtant, les chercheurs ont découvert que les mécanismes qu'ils utilisent pour naviguer dans ces différents environnements pourraient être très similaires. De façon intéressante, les résultats rassemblés dans ce travail suggèrent également que la vitesse d'une cellule est principalement définie par la viscosité corticale, tandis que la viscosité externe du fluide n'est pas pertinente.
"Avec des collaborateurs qui réalisent des expériences de cellules migrantes en suspension, nous visons à découvrir comment les cellules peuvent exploiter les mécanismes que nous décrivons, ", ont déclaré les chercheurs. "Nous voulons également faire la lumière sur les détails moléculaires de la façon dont le flux du cortex génère des forces de cisaillement dans le milieu externe, au-delà de la membrane cellulaire. Du côté théorique, nous pensons que ce modèle a encore de nombreuses variantes possibles qui peuvent produire des phénomènes intéressants qui seraient pertinents pour une gamme de dynamiques de l'actomyosine observées dans les organismes vivants."
© 2019 Réseau Science X