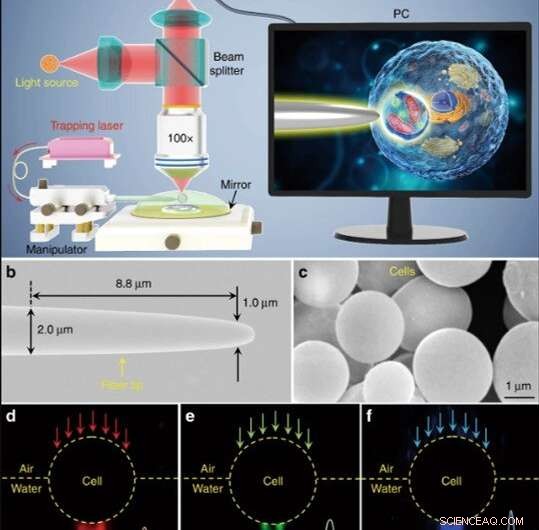
Illustration schématique et caractérisation des matériaux. (a) Illustration schématique du montage expérimental. Un microscope conventionnel en mode réflexion équipé d'une caméra CCD et d'un objectif x100 a été utilisé pour observer des échantillons et enregistrer des images. L'encart montré dans un écran de PC décrivant schématiquement comment la bioloupe est utilisée pour agrandir et imager les structures subcellulaires à l'intérieur d'un échantillon biologique. (b) Image SEM de la pointe de la fibre avec un diamètre de 1,0 m à son extrémité effilée. (c) Image SEM montrant des bioloupes à base de cellules de levure avec des surfaces lisses et des formes sphériques. d-f Images en fond noir montrant une lumière rouge à 644 nm (d), feu vert 532 nm (e), et une lumière bleue à 473 nm (f) transmise à travers la bioloupe et focalisée dans des spots lumineux de sous-longueur d'onde avec des rayons de taille de 370, 300, et 270 nm, respectivement. Crédit :Lumière :Science &Applications, doi:10.1038/s41377-019-0168-4
Les microscopes optiques et les pincettes peuvent imager et manipuler des objets à l'échelle microscopique pour des applications en biologie cellulaire et moléculaire. La résolution optique est, cependant, entravé par la limite de diffraction et donc les microscopes et les pincettes sont incapables d'imager et de manipuler directement des nano-objets. Les techniques émergentes dans les nanoscopes plasmoniques/photoniques et les nanopinces visent à atteindre une résolution à l'échelle nanométrique, bien que les structures matérielles à indice élevé puissent facilement causer des dommages mécaniques et photothermiques aux biospécimens à l'échelle nanométrique.
Dans une étude récente maintenant publiée sur Lumière :science et applications , Yuchao Li et ses collègues de l'Institut de nanophotonique en Chine, a développé un système de microscope optique utilisant des cellules vivantes comme de minuscules lentilles pour imager et manipuler des objets plus petits que la longueur d'onde de la lumière. Ils ont montré une imagerie sous-limite de diffraction et une manipulation de nano-objets avec un dispositif non invasif, qu'ils ont construit en piégeant une cellule sur une pointe de fibre. La cellule piégée a formé une bioloupe qui pouvait agrandir les nanostructures avec une résolution de 100 nm, sous microscopie à lumière blanche. À l'aide de la bioloupe, Li et al. formé un piège nano-optique pour manipuler avec précision une nanoparticule individuelle avec un rayon de 50 nm. La technique fournit un outil de haute précision pour l'imagerie optique, détection et assemblage de bio-nanomatériaux sans dommages mécaniques ou photothermiques.
L'imagerie optique pour manipuler de petits objets est cruciale pour le diagnostic médical, détection biologique, exploration cellulaire, formation moléculaire et assemblage de matériaux. Les pincettes et les microscopes sont des appareils standard pour l'imagerie et la manipulation sans contact d'échantillons minuscules allant de quelques nanomètres à plusieurs microns. Néanmoins, il est difficile d'utiliser la technologie pour imager à l'échelle nanométrique, puisque la résolution optique est limitée à environ la moitié de la longueur d'onde d'éclairage.
Les scientifiques ont réalisé des progrès spectaculaires dans les nanoscopes à champ proche et les nanopinces au cours des dernières décennies pour obtenir une imagerie optique à une résolution nanométrique. Ces techniques d'imagerie ont été retenues par les matériaux inorganiques à indice élevé tels que les métaux nobles et les semi-conducteurs utilisés pour leur fabrication, qui peuvent endommager mécaniquement des échantillons de cellules ou de tissus biologiques lors de l'imagerie et de la manipulation en champ proche.
Les scientifiques ont donc étudié des schémas d'imagerie optique plus simples basés sur des microsphères diélectriques pour surmonter la limite de diffraction commune aux microscopes conventionnels. Bien que la technique soit sans étiquette et réalisable, ces microsphères sont à base de matériaux inorganiques artificiels tels que le dioxyde de silicium (SiO
(a) Illustration schématique du montage expérimental. Un microscope conventionnel en mode réflexion équipé d'une caméra CCD et d'un objectif x100 a été utilisé pour observer des échantillons et enregistrer des images. L'encart montré dans un écran de PC décrivant schématiquement comment la bioloupe est utilisée pour agrandir et imager les structures subcellulaires à l'intérieur d'un échantillon biologique. Crédit :Lumière :Science &Applications, doi:10.1038/s41377-019-0168-4 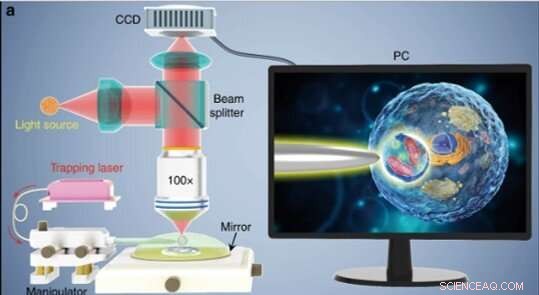
Les scientifiques ont mené toutes les expériences sous un microscope optique en mode réflexion couplé à une caméra à dispositif à couplage de charge (CCD) et à un objectif. Ils ont utilisé des sources lumineuses à 390 nm, 560 nm et 808 nm pour l'excitation, illumination et piégeage respectivement. A l'aide d'une fibre optique à pointe effilée, Li et al. piégé la bioloupe à l'extrémité de la fibre, qu'ils contrôlaient en déplaçant la pointe à l'aide d'un micromanipulateur. Li et al. sélectionné des cellules lisses et sphériques pour minimiser l'aberration de l'image et a noté que les cellules présentent de meilleures performances de mise au point lorsqu'elles sont semi-immergées dans une solution pour maintenir la viabilité des cellules.
Performances d'imagerie expérimentale de différents bioloupes. (a) Diagramme schématique montrant que la bioloupe collecte les nanostructures en champ proche d'un objet et forme une image pratiquement agrandie qui peut être capturée par un microscope optique conventionnel. (b–e) Images optiques de différentes bioloupes construites à partir de bactéries (b), levure (c), sang rouge (d), et des cellules souches (e) qui sont partiellement immergées dans une suspension cellulaire. f Image SEM d'un réseau bidimensionnel de nanosphères de silice compactées hexagonales assemblées par une technique de photophérèse. (g–j) Images optiques du réseau de nanosphères de silice amplifiées par des bioloupes basées sur la bactérie (g), levure (h), sang rouge (i), et les cellules souches (j). (k) Image SEM de la surface d'un réseau de disques Blu-ray avec une largeur de ligne de 200 nm et un espacement de 100 nm. l–o Images optiques de la structure du réseau Blu-ray agrandies par des bioloupes basées sur des bactéries (l), levure (m), sang rouge (n), et les cellules souches (o). p Profil d'intensité le long de la ligne pointillée à travers la structure de réseau Blu-ray indiquée en o. q Points bleus indiquant le facteur de grossissement M des images obtenues par les bioloupes en fonction du diamètre de la bioloupe. Crédit :Lumière :Science &Applications, doi:10.1038/s41377-019-0168-4 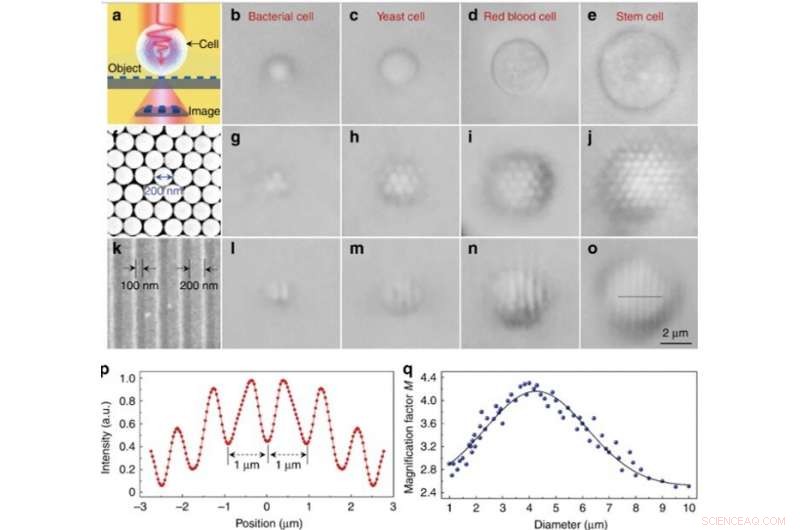
Seules les nanosphères avec des bioloupes au-dessus d'elles pourraient être résolues pendant l'imagerie, alors que les nanosphères sans bioloupe ne pouvaient pas être résolues à l'aide d'un microscope conventionnel. Le facteur de grossissement M des bioloupes à base de cellules souches a été déterminé comme étant 3,3 fois plus grand (x3,3), et les scientifiques ont montré que le M expérimental dépendait du diamètre de la bioloupe. Ensuite, Li et al. ont effectué toutes les expériences en utilisant des bioloupes de ce diamètre.
Imagerie nano-optique des structures subcellulaires et des lettres à nanomotifs. (une, b) Images optiques des structures subcellulaires d'une cellule épithéliale humaine à l'aide d'un microscope optique conventionnel (a) et de bioloupes (b). Les positions des quatre bioloupes sont marquées A–D. En comparaison, les bioloupes peuvent résoudre le cytosquelette fibreux (indiqué par A-C) à l'intérieur de la cellule et les structures à deux couches (indiquées par D) sur la membrane cellulaire, qui sont indiscernables par le microscope conventionnel. c–e SEM (c), fond noir (d), et des images optiques (e) de lettres nanomotifs JNU représentant l'acronyme de l'Université de Jinan. La largeur de ligne des lettres nanomotifs est de 100 nm, qui est inférieure à la résolution limite de diffraction du microscope optique conventionnel. f–h Images optiques montrant que la bioloupe piégée sur la pointe de la fibre peut scanner et imager les lettres J (f) à motifs nanométriques, N (g), et U (h) en déplaçant la fibre. La largeur de ligne des lettres nanomotifs a été agrandie de 100 à 400 nm. Crédit :Lumière :Science &Applications, doi:10.1038/s41377-019-0168-4 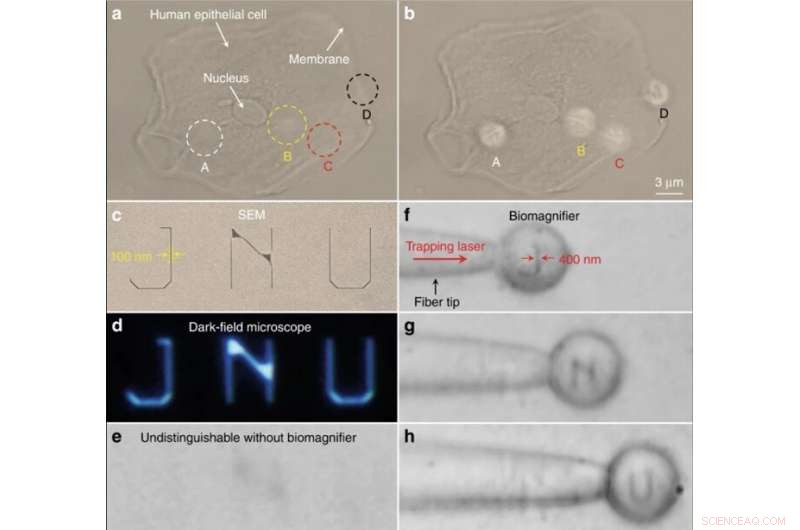
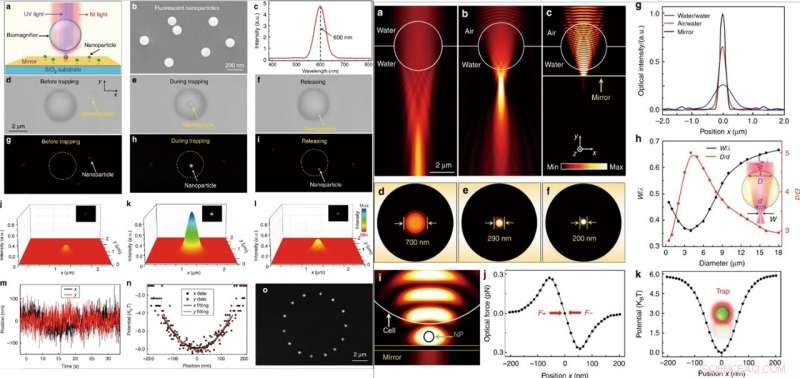
GAUCHE :Manipulation optique d'une seule nanoparticule fluorescente. (a) Diagramme schématique montrant une nanoparticule fluorescente suspendue à la surface d'un miroir et piégée par la bioloupe. (b) Image SEM montrant les nanoparticules fluorescentes PS avec un rayon moyen de 50 nm. (c) Spectre d'émission montrant la longueur d'onde d'émission centrale des nanoparticules fluorescentes situées à 600 nm. (d–f) Les images optiques montrent le processus de piégeage d'une seule nanoparticule de PS avec la bioloupe. Le procédé comportait trois étapes successives :avant piégeage (d), pendant le piégeage (e), et après libération (f). g–i Images de fluorescence montrant le spot de fluorescence de la nanoparticule PS avant d'être piégée (g), pendant le piégeage (h), et après la libération (i). j–l Cartographie tridimensionnelle des couleurs des taches de fluorescence de la nanoparticule comme indiqué en g–i. m Trace en temps réel de la position de la nanoparticule piégée dans les directions x et y. (n) Potentiel de piégeage de la nanoparticule piégée dans les directions x et y avec des raccords paraboliques. (o) Les images de fluorescence composites montrent la trace de mouvement de la nanoparticule piégée dans le plan x-y par un mouvement contrôlé de la bioloupe. DROITE :Simulation numérique et calcul. (a–c) Distributions d'intensité optique de la lumière focalisée par une bioloupe de 4 m complètement immergée dans l'eau (a), semi-immergé dans l'eau (b), et suspendu à la surface d'un miroir (c). La source lumineuse d'éclairage a été définie comme un faisceau gaussien avec une longueur d'onde de 560 nm. (d–f) Distributions d'intensité optique des taches lumineuses de la bioloupe correspondant à (a–c) dans le plan x–z. (g) Profils d'intensité optique aux plans focaux de la lumière de sortie des bioloupes dans la direction x. (h) Résultats de la simulation FEM pour la taille normalisée de la tache lumineuse w/λ (w est le rayon de taille de la tache lumineuse et est la longueur d'onde de la lumière d'entrée) et le rapport D/d (la largeur de la région linéaire où la lumière pénètre dans la bioloupe à sa surface avant est appelée D, et la largeur du faisceau lumineux de sortie au niveau de la surface arrière est (d) en fonction du diamètre de la bioloupe. (i) Distribution d'intensité simulée de la lumière de piégeage proche infrarouge montrant qu'une nanoparticule (rayon :50 nm) est piégée dans l'espace entre la bioloupe et le miroir. La puissance optique d'entrée de la lumière de piégeage a été fixée à 10 µmW. (j) Forces optiques simulées de la nanoparticule piégée dans le spot lumineux en fonction de la position de la nanoparticule le long de la direction x. (k) Potentiel de piégeage calculé de la nanoparticule piégée en fonction de la position le long de la direction x. Crédit :Lumière :Science &Applications, doi:10.1038/s41377-019-0168-4
Après, lorsqu'ils irradient simultanément des faisceaux laser proche infrarouge (IR) et UV sur la bioloupe à travers une lentille d'objectif, ils pourraient piéger et exciter les nanoparticules. Pour ces expériences, les scientifiques ont utilisé des nanoparticules fluorescentes d'un rayon moyen de 50 nm. Lorsqu'ils ont piégé une seule nanoparticule dans le foyer d'une bioloupe, ils ont observé des images optiques et fluorescentes de l'échantillon d'intérêt. Li et al. puis calculé la rigidité de piégeage de la particule en temps réel à l'aide de pinces optiques standard. La possibilité de manipuler une seule nanoparticule sans contact et précisément via l'optique sera utile pour assembler des nanostructures bien régulées. Lorsque Li et al. ont étudié numériquement le mécanisme d'imagerie et la rigidité de piégeage des bioloupes à l'aide de la simulation 3D et du logiciel COMSOL. Ils ont observé que la capacité de focalisation de la lumière à la limite de sous-diffraction résultait d'un effet combiné de « nanojet photonique » et d'une amélioration d'interférence cohérente par le miroir.
Les limites de la méthode comprenaient l'aberration et la distorsion d'imagerie dues aux structures intracellulaires non homogènes de la bioloupe naturelle, par rapport aux microsphères diélectriques avec des indices de réfraction uniformes. Heureusement, les matériaux intracellulaires étaient optiquement transparents à la lumière visible et proche infrarouge et les interactions optiques étaient relativement faibles à l'intérieur d'une seule cellule. Les activités intracellulaires pourraient également modifier la distribution de l'indice de réfraction partiel dans une cellule pour provoquer une distorsion de la lumière pendant le piégeage et l'imagerie, mais la plupart des activités intracellulaires étaient ultrarapides et n'ont pas influencé le schéma d'imagerie.
De cette façon, Yuchao Li et ses collègues ont développé une nouvelle technique d'imagerie expérimentale et vérifié les capacités expérimentales avec des simulations FEM. Li et al. nanoscopes optiques intégrés et nanopinces dans un seul appareil pour imager et manipuler des nanostructures simultanément pour la première fois dans le présent travail. Ils ont promu la résolution de la technique à 100 nm et proposé une procédure d'imagerie sans marquage. Les scientifiques envisagent la bioloupe vivante pour ouvrir de nouvelles opportunités en imagerie super-résolution, détection en temps réel et nano-assemblage précis de bionanomatériaux pour former des nanoarchitectures d'intérêt.
© 2019 Réseau Science X