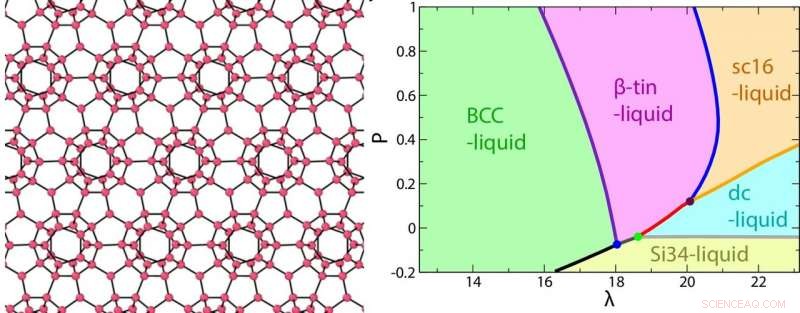
Une image de la structure clathrate (Si34) d'un liquide de type eau formé à une pression négative (à gauche) et le diagramme de phases en fonction de la force de la tétraèdre λ et de la pression P. Crédit :2018 Hajime Tanaka, Institut des sciences industrielles, L'Université de Tokyo
Une équipe de recherche basée au Japon a étudié le comportement anormal de liquides tétraédriques tels que l'eau. Par simulation informatique, ils ont calculé les diagrammes de phases d'une gamme de liquides modèles. Faire varier un paramètre appelé lambda (λ), qui contrôle la quantité de structure tétraédrique dans le liquide, ils ont constaté que les liquides avec un plus grand présentaient plus d'anomalies, comme la détente à basse température. La valeur de l'eau de maximise l'effet de la tétraèdre, d'où ses propriétés particulièrement inhabituelles.
L'eau tient une place particulière parmi les liquides pour ses propriétés inhabituelles, et reste mal compris. Par exemple, il se dilate juste au moment de la congélation en glace, et devient moins visqueux en compression, autour de la pression atmosphérique. Rationaliser ces bizarreries est un défi majeur pour la physique et la chimie. Des recherches récentes menées par l'Institut des sciences industrielles (IIS) de l'Université de Tokyo suggèrent qu'elles résultent du degré d'ordre structurel dans le fluide.
L'eau appartient à une classe de liquides dont les particules forment des structures tétraédriques locales. La tétraédralité de l'eau est une conséquence des liaisons hydrogène entre les molécules, qui sont contraints à des directions fixes. Dans une étude dans le Actes de l'Académie nationale des sciences ( PNAS ), les chercheurs ont étudié pourquoi les propriétés physiques de l'eau exprimées par son diagramme de phase sont si remarquables, même par rapport à d'autres liquides tétraédriques, comme le silicium et le carbone.
Les liquides tétraédriques sont souvent simulés par un potentiel énergétique appelé modèle SW. Le liquide est supposé contenir deux phases en équilibre thermodynamique - un état désordonné qui a une symétrie de rotation élevée, et un état tétraédriquement ordonné qui ne le fait pas. Malgré sa simplicité, le modèle prédit avec précision les comportements anormaux des liquides. La propriété à deux états est contrôlée par le paramètre lambda (λ), qui décrit la force relative des interactions intermoléculaires par paires et à trois corps. Plus est élevé, le degré d'ordre tétraédrique augmente.
"On s'est rendu compte que , ce qui est assez grand pour l'eau, était la clé de l'unicité de ces liquides, ", a déclaré le co-auteur principal de l'étude, John Russo. λ contrôle le degré de tétraédralité :lorsque λ augmente, les coquilles tétraédriques qui se forment autour de chaque molécule deviennent énergétiquement plus stables. D'où, ces coquilles surmontent la perte défavorable d'entropie qui accompagne la création de l'ordre." Les tétraèdres locaux ressemblent à des structures à l'état solide, c'est pourquoi les liquides à élevé cristallisent plus facilement.
En ajustant continuellement , ils ont simulé un ensemble de diagrammes de phases pour modéliser ce qui se passe lorsqu'un liquide "simple" devient progressivement plus semblable à de l'eau. Avec croissant, les diverses anomalies thermodynamiques et dynamiques des liquides tétraédriques, telles que l'expansion à basse température et la rupture de la loi d'Arrhenius standard pour la diffusion, se sont accentuées.
Cependant, ce n'était pas aussi simple que "plus de tétraèdres équivaut à un comportement plus étrange". L'influence de la tétraèdre a été maximisée pour l'eau, qui a =23,15. Ci-dessus ici, le comportement de la densité en fonction de la température se rapprochait à nouveau de la normale, parce que la différence de volume entre les états ordonnés et désordonnés a commencé à baisser. Ainsi, l'eau a une valeur exquisement affinée ou « Boucle d'or » de qui lui permet de basculer facilement entre l'ordre et le hasard. Cela lui confère une grande flexibilité structurelle en réponse aux changements de température ou de pression, qui est à l'origine de son comportement unique.
"Lier les propriétés observables, telles que la viscosité aux structures microscopiques, c'est ce qu'est la chimie physique, ", a déclaré le co-auteur principal Hajime Tanaka. "L'eau, la substance la plus abondante et pourtant la plus inhabituelle sur terre, a longtemps été la dernière frontière à cet égard. Nous avons été ravis qu'un simple, modèle bien connu peut expliquer pleinement l'étrangeté de l'eau, qui naît de l'équilibre délicat entre l'ordre et le désordre dans le liquide."