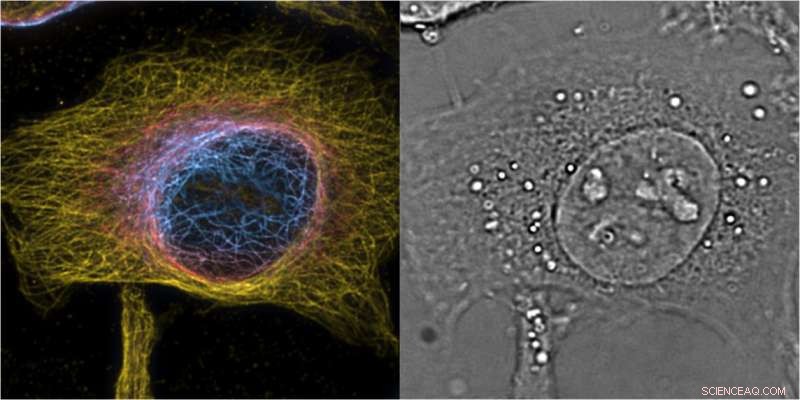
Projection d'intensité maximale des cellules HeLa de bSOFI 3D de 2ème ordre de microtubules marqués, la couleur code la position z avec une tranche de l'image de phase 3D complémentaire fournissant le contexte cellulaire. Crédit :T. Lasser/EPFL
La microscopie super-résolution est une technique qui permet de "voir" au-delà de la diffraction de la lumière, offrant des vues sans précédent des cellules et de leurs structures intérieures et organites. La technique a récemment suscité un intérêt croissant, d'autant plus que ses développeurs ont remporté le prix Nobel de chimie en 2014.
Mais la microscopie à super-résolution a une grande limitation :elle n'offre qu'une résolution spatiale. Cela pourrait suffire pour les échantillons statiques, comme des matériaux solides ou des cellules fixes, mais quand il s'agit de biologie, les choses se compliquent. Les cellules vivantes sont hautement dynamiques et dépendent d'un ensemble complexe de processus biologiques qui se déroulent sur des échelles de temps inférieures à la seconde, Tout le temps en train de changer. Donc, si nous voulons visualiser et comprendre comment les cellules vivantes fonctionnent dans la santé et la maladie, nous avons également besoin d'une résolution temporelle (ou "temporelle") élevée.
Une équipe dirigée par le professeur Theo Lasser, Le responsable du Laboratoire d'optique biomédicale (LOB) de l'EPFL a maintenant fait des progrès pour résoudre le problème en développant une technique capable d'effectuer à la fois une microscopie à super-résolution 3D et une imagerie de phase 3D rapide dans un seul instrument. L'imagerie de phase est une technique qui traduit les changements de phase de la lumière causés par les cellules et leurs organites en cartes d'indice de réfraction des cellules elles-mêmes.
La plateforme unique, qui est appelé un microscope 4-D, combine la sensibilité et la haute résolution temporelle de l'imagerie de phase avec la spécificité et la haute résolution spatiale de la microscopie à fluorescence. Les chercheurs ont développé un nouvel algorithme capable de récupérer les informations de phase à partir d'une pile d'images à fond clair prises par un microscope classique.

PRISM :module complémentaire de microscopie pour réaliser une imagerie 3D simultanée de 8 plans. Crédit :Vytautas Navikas
"Avec cet algorithme, nous présentons une nouvelle façon de réaliser une microscopie de phase quantitative 3D à l'aide d'un microscope conventionnel à fond clair, " dit Adrien Descloux, l'un des principaux auteurs de l'article. "Cela permet la visualisation et l'analyse directes des structures subcellulaires dans les cellules vivantes sans étiquetage."
Pour obtenir une imagerie 3D rapide, les scientifiques ont conçu sur mesure un prisme de division d'images, qui permet l'enregistrement simultané d'une pile de huit images déplacées en z. Cela signifie que le microscope peut effectuer une imagerie de phase 3D à grande vitesse sur un volume de 2,5μm x 50μm x 50μm. La vitesse du microscope est essentiellement limitée par la vitesse de sa caméra; pour cette démonstration, l'équipe a pu imager la dynamique intracellulaire jusqu'à 200 Hz. "Avec le prisme en complément, vous pouvez transformer un microscope classique en un imageur 3D ultra-rapide, " dit Kristin Grussmayer, un autre des principaux auteurs de l'article.
Le prisme est également adapté à l'imagerie par fluorescence 3D, que les scientifiques ont testé en utilisant l'imagerie de fluctuation optique à super résolution (SOFI). Cette méthode exploite le clignotement des colorants fluorescents pour améliorer la résolution 3D grâce à l'analyse de corrélation du signal. En utilisant ceci, les chercheurs ont réalisé une imagerie super-résolution 3D des structures colorées dans les cellules, et l'a combiné avec l'imagerie de phase sans étiquette 3-D. Les deux techniques se complètent très bien, révélant des images fascinantes de l'architecture intérieure, cytosquelette, et les organites également dans les cellules vivantes à différents moments.
« Nous sommes ravis de ces résultats et des possibilités offertes par cette technique, " dit le professeur Hilal Lashuel, dont le laboratoire de l'EPFL s'est associé à celui du professeur Lasser pour utiliser la nouvelle technique pour étudier les mécanismes par lesquels l'agrégation des protéines contribue au développement et à la progression des maladies neurodégénératives, comme la maladie de Parkinson et la maladie d'Alzheimer. "Les progrès techniques ont permis une visualisation haute résolution de la formation d'agrégats pathologiques d'alpha synucléine dans les neurones de l'hippocampe."
L'équipe a nommé la nouvelle plateforme de microscopie PRISM, pour instrument de récupération de phase avec microscopie à super-résolution. « Nous proposons PRISM en tant que nouvel outil de microscopie et prévoyons qu'il sera rapidement utilisé dans la communauté des sciences de la vie pour élargir le champ d'application de l'imagerie 3D à grande vitesse pour les investigations biologiques, ", dit Theo Lasser. "Nous espérons qu'il deviendra un outil de travail régulier pour les neurosciences et la biologie."