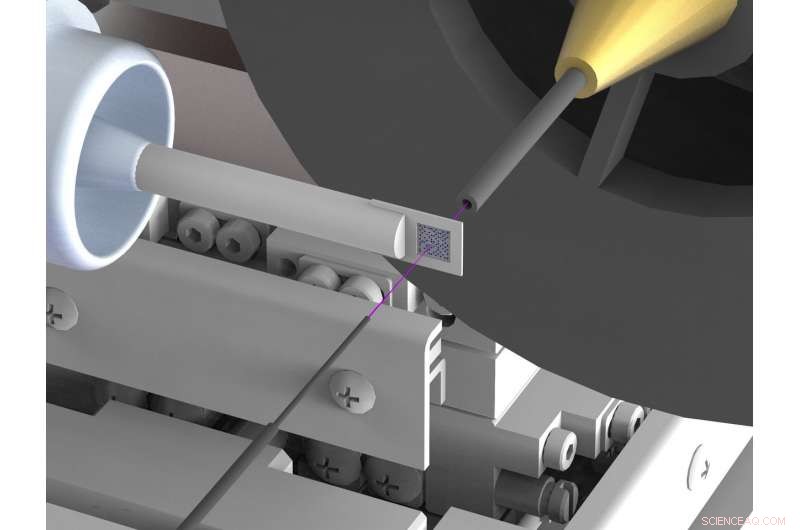
Une configuration nouvellement développée réduit considérablement la diffusion de fond dans l'analyse de la structure des rayons X de biomolécules telles que les protéines au niveau des sources de rayons X synchrotron. La diffusion entrave souvent les déterminations de structure à haute résolution. Pour y parvenir, le faisceau de rayons X (surligné en rose) est enfermé dans de minces capillaires métalliques peu avant et derrière l'échantillon et l'air entourant immédiatement l'échantillon est remplacé par un courant d'hélium gazeux. Crédit :DESY, Julien Bergtholdt
Une configuration expérimentale nouvellement développée permet la détermination de la structure aux rayons X de biomolécules telles que les protéines avec des échantillons beaucoup plus petits et des temps d'exposition plus courts qu'auparavant. Aux sources dites synchrotron, le cristal de protéine peut être étudié considérablement plus efficacement et plus rapidement en utilisant des rayons X à large spectre. Cependant, en raison de la grande quantité de rayonnement diffusé, cela a nécessité jusqu'à présent de très gros cristaux. Le dispositif expérimental nouvellement développé permet désormais de réduire considérablement le rayonnement diffusé indésirable, de sorte que les scientifiques ont pu pour la première fois réaliser une cristallographie en série à l'aide d'un rayonnement synchrotron à large spectre. L'équipe internationale dirigée par le scientifique de DESY, Alke Meents, a publié ses résultats d'expériences à l'Advanced Photon Source (APS) aux États-Unis dans la revue Communication Nature .
Les sources synchrotron sont des accélérateurs de particules circulaires qui produisent un rayonnement X brillant. Ces sources de rayons X sont les chevaux de bataille pour la détermination de la structure des protéines. Pour élucider la structure spatiale d'une protéine particulière, des cristaux sont développés à partir de celui-ci et étudiés avec des rayons X dans un synchrotron. Le cristal diffracte les rayons X de manière caractéristique, et à partir du diagramme de diffraction résultant la structure interne du cristal, et avec elle la structure de la protéine peut être calculée jusqu'au niveau atomique.
Contrairement à la cristallographie aux rayons X classique, qui est généralement réalisée sur un seul ou un petit nombre de gros cristaux de protéines, la cristallographie en série examine une centaine à des centaines de milliers de très petits cristaux. Les informations collectées sont ensuite fusionnées pour former un ensemble de données à partir duquel la structure cristalline peut être déduite. Cette méthode a déjà été fréquemment appliquée à l'aide de lasers à rayons X à électrons libres (XFEL). En outre, en utilisant les impulsions de rayons X très courtes des XFEL, les réactions chimiques et enzymatiques peuvent être étudiées sur de courts intervalles de temps.

Image de diffraction d'un cristal de protéine en polychromie, radiographies « roses ». Par rapport aux images de diffraction des rayons X monochromatiques, l'image polychromatique contient beaucoup plus d'informations et moins de cristaux sont nécessaires pour déterminer la structure de la protéine. Crédit :DESY, Max Wiedorn
"La cristallographie en série peut également être réalisée facilement à l'aide de sources synchrotron. Cependant, les mesures prennent plus de temps avec ces sources, parce qu'ils utilisent des rayons X monochromatiques d'une couleur spécifique, résultant en un faible flux des rayons X, " explique Henry Chapman, scientifique de premier plan à DESY et co-auteur de l'article. Aux synchrotrons, généralement, seule une bande étroite de longueurs d'onde de rayons X est utilisée pour ce type d'analyse, de sorte que seule une petite fraction des photons de rayons X disponibles est utilisée pour l'expérience. nous avons besoin de nombreux cristaux pour collecter un ensemble complet de données - souvent plusieurs dizaines de milliers. Les temps d'exposition étant relativement longs avec un synchrotron, la seule façon d'étudier les réactions rapides a été avec un laser à rayons X, " dit Chapman.
En utilisant le faisceau polychrome dit "rose", des expériences de cristallographie en série avec des temps d'exposition très courts peuvent désormais également être menées sur des sources de rayonnement synchrotron. Par rapport au faisceau monochromatique habituel, le large spectre augmente le nombre de photons de rayons X disponibles pour effectuer une mesure. Comme prendre des photos par une journée très ensoleillée, les photos peuvent être prises avec des temps d'exposition plus courts, ce qui signifie que des réactions rapides peuvent être examinées à l'aide de sources de rayonnement synchrotron. Les expériences elles-mêmes peuvent également être réalisées avec moins de cristaux car le large spectre donne des motifs de diffraction "colorés" plus complexes avec plus d'informations sur la structure moléculaire que l'utilisation de rayons X monochromatiques d'une seule "couleur".
Jusqu'à maintenant, cependant, il n'a pas été possible d'effectuer une cristallographie en série en utilisant le faisceau rose car les mesures sont gravement altérées par les niveaux élevés de bruit de fond produits avec des faisceaux aussi puissants. "Un arrière-plan indésirable dans les motifs mesurés est produit parce que les rayons X utilisés pour sonder l'échantillon ne sont pas seulement diffusés par les molécules dans le cristal lui-même, mais aussi par le porte-échantillon et l'air ambiant, " explique Max Wiedorn, DESY co-auteur de l'article . "Le signal réel mesuré lors des expériences avec le faisceau rose se répartit sur les nombreuses "couleurs", ce qui signifie que le rayonnement de fond diffusé a un impact nettement plus négatif sur les mesures que ce n'est le cas avec un rayonnement monochromatique."
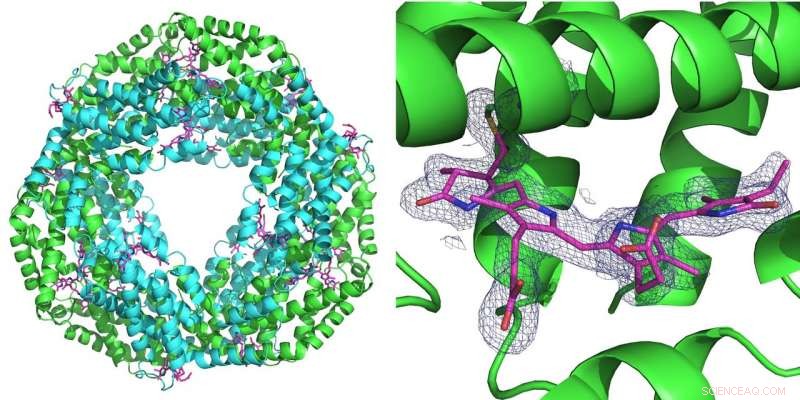
A gauche :La première mesure réalisée avec le nouveau montage a été réalisée sur la protéine phycocyanine qui joue un rôle dans la photosynthèse chez les cyanobactéries. Il forme un anneau de six molécules doubles (hétérodimères). A chaque hétérodimère trois molécules de phycocyanobiline (rose) peuvent se lier. A droite :la grille bleue représente la densité électronique d'une molécule de phycocyanobiline liée. Les deux structures ont été calculées à partir de seulement 52 images de diffraction enregistrées avec le faisceau rose de la source avancée de photons (APS) sur la ligne de lumière BioCARS. Crédit :DESY, Julia Lieske
Les scientifiques ont donc mis au point une nouvelle configuration, qui supprime en grande partie le rayonnement diffusé indésirable. Ils utilisent un porte-échantillon en silicone, qui ne diffuse pas les rayons X; aussi, ils assurent qu'il y a très peu d'air dans le trajet du faisceau de rayons X. Pour y parvenir, le faisceau de rayons X est enfermé dans un tube métallique mince juste avant et derrière l'échantillon, qui empêche le rayonnement diffusé d'atteindre la caméra à rayons X. Aussi, l'air entourant immédiatement l'échantillon est remplacé par un courant d'hélium gazeux, ce qui provoque moins de diffusion que l'air. En supprimant le rayonnement diffusé, les scientifiques sont maintenant parvenus pour la première fois à déterminer la structure tridimensionnelle de deux protéines avec une très grande précision au moyen d'une cristallographie en série à faisceau rose sur un synchrotron. Les mesures correspondantes ont été effectuées sur la ligne de lumière BioCARS de l'Advanced Photon Source (APS) du Argonne National Laboratory aux États-Unis.
"Un gros avantage de cette méthode est qu'elle peut être utilisée pour réaliser des études très précises des structures des protéines, mais ne nécessite qu'une fraction de l'échantillon, " explique Meents du Center for Free Electron Laser Science (CFEL) une coopération de DESY, l'université de Hambourg et la société allemande Max Planck. la petite taille de l'échantillon et la rapidité de la méthode permettent de réaliser un grand nombre de mesures en peu de temps, par exemple dans la recherche pharmaceutique, où l'on aimerait savoir quelles substances actives potentielles se lient à une protéine spécifique qui est impliquée dans une maladie. la nouvelle méthode nécessite beaucoup moins de temps pour réaliser l'ensemble de l'expérience, qui permettra des mesures à haut débit des structures cristallines.
Par ailleurs, car les mesures peuvent être effectuées à température ambiante, les changements structurels tels que ceux qui se produisent lorsqu'une substance active se lie à une protéine ciblée peuvent à l'avenir être étudiés dans le temps. La nouvelle méthode atteint une résolution temporelle très élevée de 100 picosecondes, quelque chose qui n'était pas possible aux synchrotrons avec les rayons X monochromatiques utilisés dans le passé. Une picoseconde est un millionième de millionième de seconde. Un faisceau de lumière parcourt environ trois centimètres en 100 picosecondes.