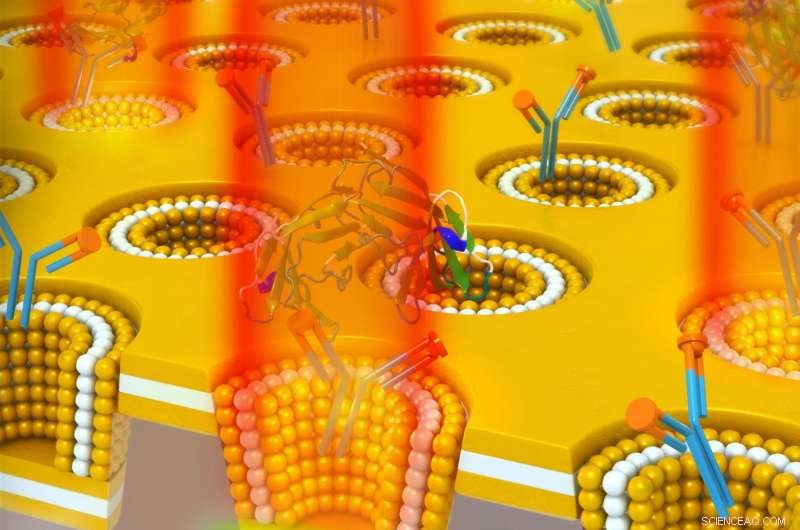
Une conception de cavité métallique-isolant-métal-isolant-métal de nanocup plasmonique utilisée pour détecter le biomarqueur de cancer CEA. La nanocavité conduit à un stockage d'énergie optique qui est découplé au champ lointain par une augmentation de l'indice de réfraction. Par conséquent, La liaison du CEA à son anticorps immobilisé conduit à une augmentation sensible de l'intensité de transmission à la longueur d'onde de résonance sans décalage spectral. Crédit :Université de l'Illinois
Un nouveau capteur plasmonique développé par des chercheurs de l'Université de l'Illinois à Urbana-Champaign servira de détection précoce fiable de biomarqueurs pour de nombreuses formes de cancer et éventuellement d'autres maladies.
Le capteur s'est avéré fiable pour détecter la présence de l'antigène carcinoembryonnaire (ACE) biomarqueur du cancer à l'ordre de 1 nanogramme par millilitre. La plupart des humains transportent au moins certaines quantités de CEA avec une fourchette moyenne de 3 à 5 nanogrammes par millilitre. Les chercheurs ont choisi de se concentrer sur le CEA car sa présence à des concentrations plus élevées est un indicateur précoce de nombreuses formes de cancer, y compris les cancers du poumon et de la prostate.
"Le cancer est l'une des principales causes de décès aux États-Unis car plus de la moitié des nouveaux patients sont diagnostiqués après qu'il se soit déjà propagé, " Ameen a expliqué. "Cela montre la gravité avec laquelle ce problème doit être résolu et cette nouvelle conception d'un capteur plasmonique aide à détecter la plus faible concentration de CEA à un état antérieur."
Le capteur plasmonique est une amélioration de la méthode de pointe actuelle pour plusieurs raisons. D'abord, il a pu améliorer la limite de détection d'au moins deux ordres de grandeur. En réalité, la plupart des méthodes ne sont pas en mesure de détecter avec précision la présence de CEA jusqu'à ce qu'il atteigne une concentration plus élevée.
Deuxièmement, car il fonctionne avec beaucoup moins d'instrumentation, il est moins cher et plus portable et ne nécessite pas presque l'expertise pour faire une lecture. Cela signifie également qu'au lieu d'avoir besoin d'un flacon de sang pour un test, une simple piqûre au doigt fera l'affaire. Cet aspect sera particulièrement important pour ceux qui ne vivent pas à proximité d'un établissement médical avancé, y compris ceux des pays en développement.
L'équipe de recherche était dirigée par Logan Liu, et Lynford Goddard, professeurs agrégés de génie électrique et informatique avec les étudiants Abid Ameen et Lisa Hackett réalisant le projet. L'équipe a publié ses résultats dans Matériaux optiques avancés comme article de couverture.
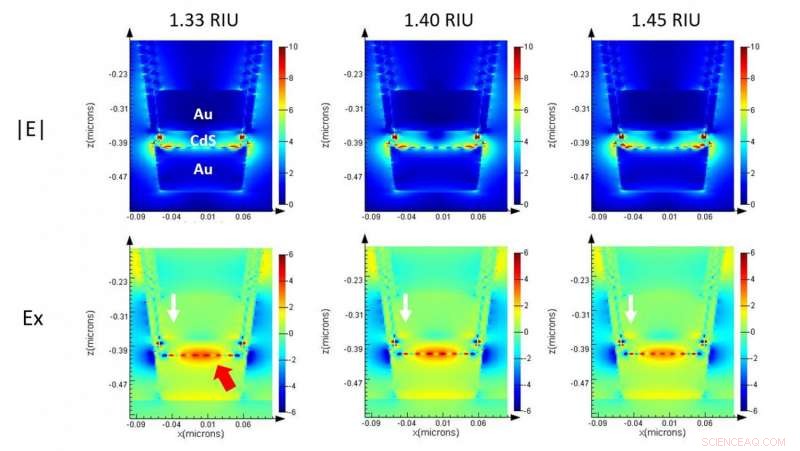
Simulation électromagnétique d'une seule nanocup sur ML-nanoLCA montrant l'intensité du champ dans la section efficace. Crédit :Université de l'Illinois
L'appareil combine deux méthodes de détection, qui n'avaient jusqu'alors pas pu être utilisés ensemble. D'abord, il utilise une nanocavité multicouche 3D dans un réseau de nanocups, ce qui permet de stocker la lumière dans la cavité constituée de deux couches métalliques (en l'occurrence de l'or) entourant une couche isolante.
Deuxièmement, il utilise la détection plasmonique, qui détecte les interactions lumière-matière nanométriques sensibles avec des biomolécules à la surface de l'appareil. Il produit un confinement de champ amélioré et un champ localisé amélioré. En raison de la structure plasmonique, la lumière est découplée plus efficacement lorsque l'indice de réfraction environnant change.
"En combinant les propriétés plasmoniques et les propriétés de la cavité optique dans un seul appareil, nous sommes en mesure de détecter une concentration plus faible de biomarqueur par confinement et transmission de la lumière dans la couche de cavité et depuis le haut de l'appareil respectivement, en fonction de l'épaisseur des multicouches et de l'indice de réfraction de la couche de cavité, " expliqua Ameen.
"Le réseau nanocup offre une transmission optique extraordinaire, " ajouta Hackett. " Si vous prenez une fine pellicule de métal et essayez de la faire briller, il n'y aura presque pas de lumière transmise. Cependant, si vous mettez un tableau périodique de nanotrous, ou dans notre cas une structure nanocup, alors ce que vous voyez est une condition de résonance où à une certaine longueur d'onde, vous aurez un pic de transmission à travers cet appareil."
Parce que la résonance change à une seule longueur d'onde et parce que les caractéristiques spectrales ont des emplacements de référence, l'excitation et la détection peuvent être effectuées de manière fiable sans aucun équipement spécialisé. Avec cet appareil, une source lumineuse LED peut être utilisée à la place d'un laser et une cellule photoélectrique ou une image de caméra peut être utilisée à la place d'un spectromètre haut de gamme.
"Grâce à notre structure plasmonique multicouche haute performance, nous avons pu diffuser très efficacement la lumière dans le champ lointain, " dit Hackett. " Lorsque vous augmentez l'indice de réfraction de la région de détection, il provoque le couplage de l'énergie stockée. Habituellement, lorsque vous disposez de ces types de capteurs plasmoniques réfractométriques, vous avez un changement d'angle ou un changement de votre longueur d'onde lorsque la condition de résonance est remplie. Dans notre cas, parce que nous avons incorporé une nanocavité, nous avons une longueur d'onde de résonance fixe."
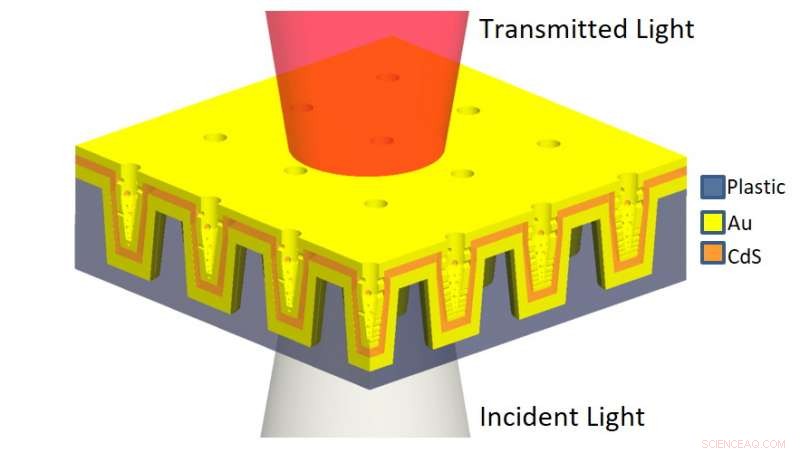
L'illustration schématique du nanoLCA multicouche (ML-nanoLCA) montre la structure multicouche et la direction de l'éclairage. Crédit :Université de l'Illinois à Urbana-Champaign
Au fur et à mesure que la concentration de biomolécules (en l'occurrence le CEA) augmente, l'indice de réfraction aussi, ce qui produit une augmentation de l'intensité de transmission à une longueur d'onde fixe qui peut être facilement détectée.
"Ce que cela signifie à l'avenir, c'est que nous pouvons prendre ce capteur, que nous avons optimisé et incorporé avec une LED et avons l'instrumentation la plus compacte, en fait aucune instrumentation sophistiquée, " a déclaré Ameen. " Cela permet à la détection plasmonique de haute performance d'aller vers des systèmes de détection portables et des capteurs portables à grande échelle. "
Pour l'instant, des méthodes de détection des biomarqueurs du cancer sont mises en œuvre chez les patients à haut risque, en particulier les patients cancéreux en rémission. Ils prennent du temps, équipement spécialisé, et sont à forte intensité de main-d'œuvre.
À l'avenir, cependant, en raison de la portabilité et de la nature peu coûteuse de cette méthode, il peut être plus facilement administré à n'importe quel patient lors d'examens de routine. Cela permettrait de traiter les personnes ayant une concentration élevée de CEA avant même que les cellules cancéreuses ne se propagent dans le corps.
« En ce moment, le cancer est détecté plus près du stade final, " Ameen a noté. "Nous voulons le détecter le plus tôt possible. Notre appareil nous offre cette opportunité."
Bien que cette étude ait démontré la détection dans un petit échantillon de sérum humain, la méthode pourrait être utilisée pour la détection d'autres maladies plus tard.
"À l'avenir, s'ils sont rendus très rentables et portables, " Hackett a dit, "Ce serait formidable de voir les gens être en mesure de prendre plus de contrôle sur leur santé et de surveiller eux-mêmes quelque chose comme ça."