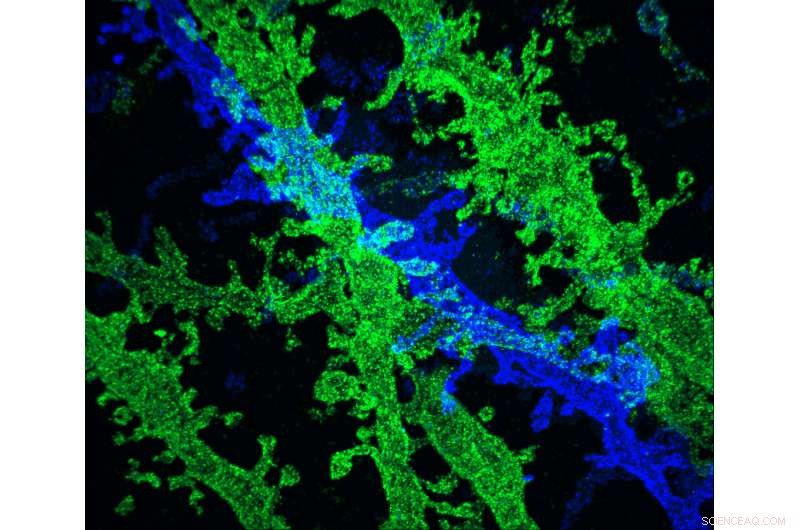
Les chercheurs du MIT ont développé un moyen de créer des images à très haute résolution d'échantillons de tissus, à une fraction du coût des autres techniques offrant une résolution similaire. Crédit :Les Chercheurs
Les chercheurs du MIT ont développé un moyen de créer des images à très haute résolution d'échantillons de tissus, à une fraction du coût des autres techniques offrant une résolution similaire.
La nouvelle technique repose sur l'expansion du tissu avant de l'imager avec un microscope optique conventionnel. Il y a deux ans, l'équipe du MIT a montré qu'il était possible de multiplier par 100 les volumes de tissus, résultant en une résolution d'image d'environ 60 nanomètres. Maintenant, les chercheurs ont montré que l'expansion du tissu une deuxième fois avant l'imagerie peut augmenter la résolution à environ 25 nanomètres.
Ce niveau de résolution permet aux scientifiques de voir, par exemple, les protéines qui se regroupent selon des schémas complexes au niveau des synapses cérébrales, aider les neurones à communiquer entre eux. Cela pourrait également aider les chercheurs à cartographier les circuits neuronaux, dit Ed Boyden, professeur agrégé de génie biologique et de sciences du cerveau et cognitives au MIT.
"Nous voulons pouvoir tracer le câblage de circuits cérébraux complets, " dit Boyden, l'auteur principal de l'étude. "Si vous pouviez reconstruire un circuit cérébral complet, peut-être pourriez-vous créer un modèle informatique de la façon dont il génère des phénomènes complexes tels que des décisions et des émotions. Puisque vous pouvez cartographier les biomolécules qui génèrent des impulsions électriques dans les cellules et qui échangent des produits chimiques entre les cellules, vous pourriez potentiellement modéliser la dynamique du cerveau."
Cette approche pourrait également être utilisée pour imager d'autres phénomènes tels que les interactions entre les cellules cancéreuses et les cellules immunitaires, détecter les agents pathogènes sans équipement coûteux, et de cartographier les types cellulaires du corps.
L'ancien postdoctorant du MIT Jae-Byum Chang est le premier auteur de l'article, qui paraît dans le numéro du 17 avril de Méthodes naturelles .
Double expansion
Pour étendre des échantillons de tissus, les chercheurs les encastrent dans un dense, gel uniformément généré en polyacrylate, un matériau très absorbant qui est également utilisé dans les couches. Avant la formation du gel, les chercheurs étiquettent les protéines cellulaires qu'ils souhaitent imager, utilisant des anticorps qui se lient à des cibles spécifiques. Ces anticorps portent des "codes-barres" constitués d'ADN, qui à leur tour sont attachés à des molécules de réticulation qui se lient aux polymères qui composent le gel expansible. Les chercheurs décomposent ensuite les protéines qui maintiennent normalement le tissu ensemble, permettant aux codes-barres d'ADN de s'étendre les uns des autres à mesure que le gel gonfle.
Ces échantillons agrandis peuvent ensuite être marqués avec des sondes fluorescentes qui lient les codes-barres ADN, et imagé avec des microscopes confocaux disponibles dans le commerce, dont la résolution est généralement limitée à des centaines de nanomètres.
En utilisant cette approche, les chercheurs étaient auparavant capables d'atteindre une résolution d'environ 60 nanomètres. Cependant, "les biomolécules individuelles sont beaucoup plus petites que cela, disons 5 nanomètres ou même plus petit, " dit Boyden. " Les versions originales de la microscopie à expansion étaient utiles pour de nombreuses questions scientifiques, mais ne pouvaient pas égaler les performances des méthodes d'imagerie à plus haute résolution telles que la microscopie électronique. "
Dans leur étude originale de microscopie à expansion, les chercheurs ont découvert qu'ils pouvaient agrandir le tissu de plus de 100 fois en volume en réduisant le nombre de molécules de réticulation qui maintiennent le polymère de manière ordonnée. Cependant, cela a rendu le tissu instable.
"Si vous réduisez la densité de réticulation, les polymères ne conservent plus leur organisation pendant le processus d'expansion, " dit Boyden, qui est membre du Media Lab du MIT et du McGovern Institute for Brain Research. "Vous perdez l'information."
Au lieu, dans leur dernière étude, les chercheurs ont modifié leur technique pour qu'après la première expansion tissulaire, ils peuvent créer un nouveau gel qui gonfle le tissu une seconde fois, une approche qu'ils appellent « expansion itérative ».
Cartographie des circuits
En utilisant l'expansion itérative, les chercheurs ont pu imager des tissus avec une résolution d'environ 25 nanomètres, ce qui est similaire à celui obtenu par des techniques à haute résolution telles que la microscopie à reconstruction optique stochastique (STORM). Cependant, la microscopie à expansion est beaucoup moins chère et plus simple à réaliser car aucun équipement ou produit chimique spécialisé n'est requis, dit Boyden. La méthode est également beaucoup plus rapide et donc compatible avec les applications à grande échelle, Imagerie 3D.
La résolution de la microscopie à expansion ne correspond pas encore à celle de la microscopie électronique à balayage (environ 5 nanomètres) ou de la microscopie électronique à transmission (environ 1 nanomètre). Cependant, les microscopes électroniques sont très chers et peu disponibles, et avec ces microscopes, il est difficile pour les chercheurs d'étiqueter des protéines spécifiques.
Dans le Méthodes naturelles papier, l'équipe du MIT a utilisé l'expansion itérative pour imager les synapses, les connexions entre les neurones qui leur permettent de communiquer entre eux. Dans leur étude originale de microscopie à expansion, les chercheurs ont pu imager des protéines d'échafaudage, qui aident à organiser les centaines d'autres protéines présentes dans les synapses. Avec le nouveau, résolution améliorée, les chercheurs ont également pu voir des structures à plus petite échelle, tels que l'emplacement des récepteurs de neurotransmetteurs situés sur les surfaces des cellules "postsynaptiques" du côté récepteur de la synapse.
"Mon espoir est que nous puissions, Dans les années à venir, vraiment commencer à cartographier l'organisation de ces protéines d'échafaudage et de signalisation au niveau de la synapse, " dit Boyden.
La combinaison de la microscopie à expansion avec un nouvel outil appelé multiplexage temporel devrait aider à y parvenir, il croit. Actuellement, seul un nombre limité de sondes colorées peut être utilisé pour imager différentes molécules dans un échantillon de tissu. Avec le multiplexage temporel, les chercheurs peuvent marquer une molécule avec une sonde fluorescente, prendre une image, puis rincez la sonde. Cela peut ensuite être répété plusieurs fois, à chaque fois en utilisant les mêmes couleurs pour étiqueter différentes molécules.
"En combinant expansion itérative et multiplexage temporel, nous pourrions en principe avoir une couleur essentiellement infinie, imagerie à résolution nanométrique sur de grands volumes 3D, " dit Boyden. " Les choses deviennent vraiment excitantes maintenant que ces différentes technologies pourraient bientôt se connecter les unes aux autres. "
Les chercheurs espèrent également réaliser un troisième cycle d'expansion, qu'ils croient pouvoir, en principe, permettent une résolution d'environ 5 nanomètres. Cependant, à l'heure actuelle, la résolution est limitée par la taille des anticorps utilisés pour marquer les molécules dans la cellule. Ces anticorps mesurent environ 10 à 20 nanomètres de long, donc pour obtenir une résolution en dessous de cela, les chercheurs devraient d'abord créer des étiquettes plus petites ou étendre les protéines les unes des autres, puis délivrer les anticorps après expansion.