Les peptides sont de courts brins d’acides aminés de plus en plus utilisés en thérapeutique, comme biomatériaux et comme sondes chimiques et biologiques. La capacité d'isoler, de manipuler et de marquer des peptides et des protéines plus grosses est toutefois limitée par la capacité à attacher de manière fiable des molécules fonctionnelles, telles que des composés fluorescents, aux peptides dans des emplacements qui n'affecteront pas la structure tridimensionnelle et la fonction du court-circuit. brin d'acide aminé.
Les chercheurs sont plus intéressés par l'ajout de molécules fonctionnelles à l'extrémité N-terminale, ou à l'extrémité d'un peptide avec un groupe amine libre (NH2 ), d'un brin d'acide aminé afin de minimiser l'interférence des molécules fonctionnelles avec la structure et la fonction du peptide lié.
Les méthodes antérieures de fixation de molécules fonctionnelles à l'extrémité N-terminale des peptides étaient insuffisantes pour plusieurs raisons :(1) les groupes fonctionnels se libéreraient du peptide dans des conditions physiologiques humaines, (2) un seul groupe fonctionnel pouvait être attaché à un peptide à un moment donné. temps, (3) l'attachement des molécules fonctionnelles aux peptides n'était pas uniforme, ou (4) les réactions n'étaient tout simplement pas efficaces.
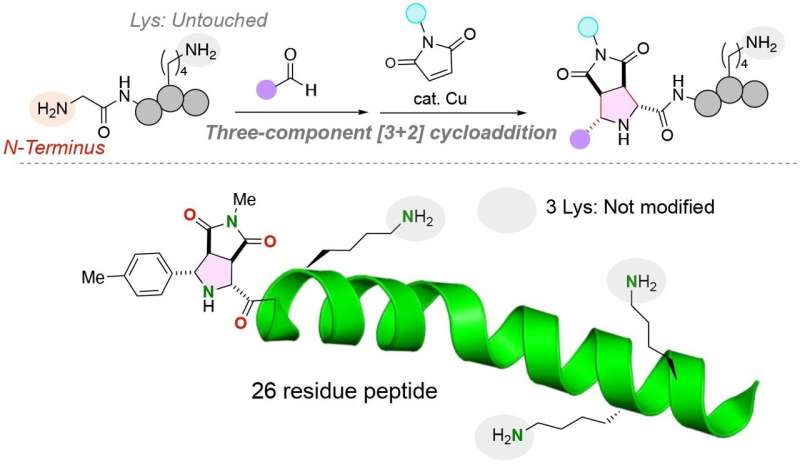
Pour résoudre ce problème, des chercheurs de l’Université de Tohoku et de l’Université de Chuo ont développé une réaction chimique unique pour attacher deux molécules fonctionnelles distinctes à l’extrémité N-terminale d’un peptide avec un acide aminé glycine à l’extrémité N-terminale. Les chercheurs ont publié leur étude dans le numéro du 28 janvier 2024 de la revue Angewandte Chemie International Edition. .
"Le défi [dans la modification des structures peptidiques] réside dans la réalisation d'une modification sélective d'un site, en particulier en présence de résidus lysine hautement réactifs. Notre approche se distingue par sa capacité à fonctionnaliser exclusivement l'extrémité N-terminale des peptides, quels que soient les résidus lysine, ce qui entraîne dans des conjugués structurellement uniformes avec des rendements élevés.
"En outre, le protocole à trois composants facilite l'installation simultanée de deux molécules fonctionnelles dans un peptide", a déclaré Kazuya Kanemoto, auteur principal de l'article et professeur adjoint à l'École supérieure des sciences pharmaceutiques de l'Université de Tohoku au Japon.
L'équipe a réussi à attacher les deux molécules fonctionnelles distinctes à l'acide aminé glycine en utilisant un catalyseur au cuivre dans une réaction à trois composants de peptides, les aldéhydes (tout composé organique avec un atome de carbone partageant une double liaison avec un atome d'oxygène, une simple liaison avec un atome d'hydrogène et une simple liaison avec un autre atome) et les maléimides, molécules qui sont des éléments constitutifs importants dans les réactions de synthèse organique.
Remarquablement, la réaction est effectuée dans un seul pot dans des conditions douces, ce qui entraîne une réaction très efficace avec des liaisons carbone-carbone stables entre l'extrémité N-terminale du peptide et les molécules fonctionnelles.
Les acides aminés lysine, en particulier, ont compliqué l’ajout de molécules fonctionnelles à l’extrémité N-terminale des peptides. Le groupe fonctionnel des acides aminés lysine est un groupe amine qui pourrait potentiellement entrer en compétition avec le groupe amine présent à l’extrémité N-terminale d’un brin peptidique. Il est important de noter que la réaction chimique développée par l'équipe de recherche marque uniquement le groupe de peptides anime N-terminal, même si un acide aminé lysine, contenant un groupe amine alternatif, est présent dans le peptide.
L'équipe de recherche a découvert que l'attachement N-terminal des groupes fonctionnels aux peptides pouvait être optimisé pour une variété de di-, tri- et oligopeptides, démontrant l'utilité potentielle de la réaction dans le marquage de divers peptides et de protéines potentiellement plus grosses à des fins de purification, de détection et à d'autres fins. .
Les chercheurs testent déjà la fonction des peptides qui ont été modifiés grâce à leur nouvelle réaction afin de déterminer l'adéquation du produit final à diverses fins de recherche et thérapeutiques.
"Nos étapes ultérieures impliquent l'évaluation de l'activité biologique des peptides préparés par cette réaction. De plus, nous visons à étendre l'application de ce protocole de double modification sélective au site à des peptides plus gros tels que des protéines et des anticorps, ce qui semble prometteur pour les progrès dans l'administration de médicaments." dit Kanemoto.
Plus d'informations : Haruka Machida et al, Double modification spécifique au N-Terminal des peptides par cycloaddition [3+2] catalysée par le cuivre, Angewandte Chemie International Edition (2024). DOI:10.1002/anie.202320012
Fourni par l'Université du Tohoku