Dans le corps humain, des molécules appelées kinases propagent des signaux à l'intérieur et entre les cellules, relayant les signaux qui permettent aux cellules de réagir aux changements de l'environnement. Cependant, il existe des centaines de kinases différentes dans le corps, et identifier leurs fonctions individuelles et collectives est un défi.
Dans une nouvelle étude, le pharmacologue de Yale Benjamin Turk et ses collègues ont développé des outils qui peuvent aider les chercheurs à se concentrer sur les rôles des kinases individuelles et à commencer à découvrir une image plus complète de leur contribution collective à la fonction biologique.
Et comme les kinases dysfonctionnelles sont souvent impliquées dans le cancer, une compréhension plus fine de leur fonction pourrait donner lieu à de meilleurs traitements à l'avenir, affirment-ils.
Les résultats ont été publiés dans Nature .
Les kinases sont des enzymes qui facilitent un processus appelé phosphorylation. Dans les cas impliquant des protéines, une protéine kinase recrute un morceau d'une molécule appelé groupe phosphate (un fragment moléculaire constitué d'un atome de phosphore et de quatre atomes d'oxygène) et aide à l'attacher à une zone spécifique d'une protéine appelée site de phosphorylation. Cela peut modifier la fonction de la protéine de plusieurs manières, en modifiant son activité ou l'endroit où elle se déplace, par exemple.
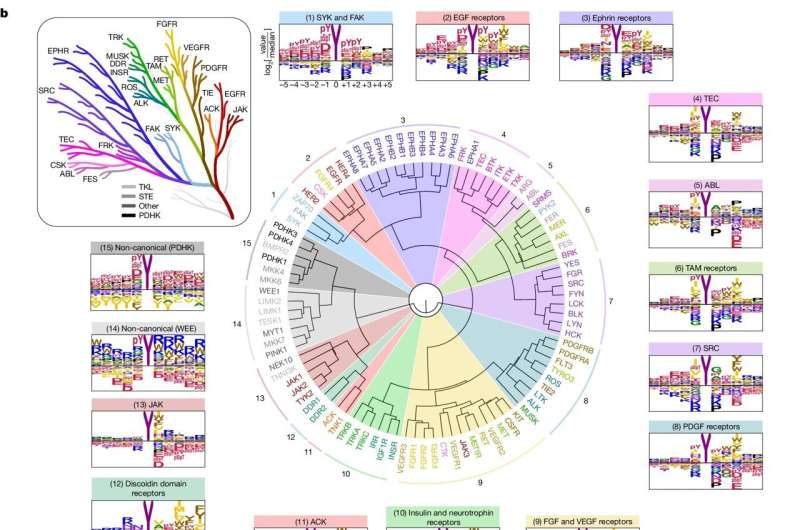
Il existe deux types de protéines kinases en fonction des protéines qu'elles phosphorylent :les sérine/thréonine kinases, sur lesquelles Turk s'est concentré dans une étude précédente, et les tyrosine kinases, le sujet de la nouvelle étude.
"Les tyrosine kinases, en particulier, sont très importantes pour la communication de cellule à cellule et d'organe à organe", a déclaré Turk, professeur agrégé de pharmacologie à la Yale School of Medicine. "La principale classe de tyrosine kinases est associée aux facteurs de croissance. Comprendre comment les tyrosine kinases signalent est essentiel pour comprendre comment les cellules communiquent entre elles, cette communication étant souvent un signal de croissance ou de division."
Tous les types de tyrosine kinases, dont 78 chez l'homme, ont tendance à envoyer trop de signaux de croissance lorsqu'elles deviennent hyperactivées, ce qui est un événement clé dans la croissance tumorale, explique Turk.
"Ce type d'étude nous aide à comprendre l'organisation de la signalisation des tyrosine kinases, ce qui nous donne un aperçu de la façon dont les kinases envoient des signaux de croissance et comment le blocage des kinases pourrait conduire à une réponse thérapeutique", a-t-il déclaré.
Pour l’étude, les chercheurs ont d’abord examiné comment les kinases reconnaissent leurs cibles. Les protéines sont constituées d’acides aminés, au nombre de 20 ; les kinases reconnaissent les courtes chaînes d'acides aminés qui entourent le site qu'elles phosphorylent.
Plus précisément, les chercheurs ont distribué chacune des 78 tyrosine kinases dans des puits individuels de plaques de laboratoire, les ont mélangées avec un grand nombre de chaînes d'acides aminés différentes, puis ont examiné quelles chaînes les kinases préféraient phosphoryler. Ils ont ensuite comparé les chaînes préférées des kinases aux protéines du corps humain.
"Et nous avons appris quelques choses en faisant cela", a déclaré Turk.
Premièrement, ils pourraient, dans une certaine mesure, commencer à faire correspondre les kinases à leurs cibles dans le corps, ce qui donne aux chercheurs des informations sur le rôle spécifique d'une kinase particulière.
Peut-être plus important encore, leurs découvertes leur ont permis de découvrir certaines des règles plus larges de l’activité de la tyrosine kinase. C'était comme s'ils commençaient à voir le câblage d'une maison plutôt que simplement l'emplacement des prises individuelles, a déclaré Turk.
L’une de ces règles concerne la manière dont les tyrosine kinases recrutent des kinases supplémentaires pour propager une cascade de signalisation. Une autre concerne la façon dont les acides aminés entourant un site de phosphorylation dictent non seulement l'endroit où la phosphorylation aura lieu, mais également la vitesse à laquelle elle se produira.
Et, point important pour le développement de traitements, les outils développés dans cette étude permettent aux chercheurs de déduire quelles kinases pourraient être actives dans une cellule ou un tissu à un moment donné et dans quelle mesure leur perturbation pourrait affecter leur fonction.
"Nous pouvons utiliser des médicaments pour inhiber des kinases individuelles, et lorsque nous le faisons, nous pouvons voir l'activité de cette kinase diminuer", a déclaré Turk. "Et les inhibiteurs de la tyrosine kinase sont l'un des principaux traitements ciblés contre le cancer. Mais les cellules cancéreuses peuvent s'adapter à ce type de thérapie et y devenir résistantes, provoquant une rechute des patients."
Grâce à leurs outils, les chercheurs peuvent observer comment le blocage d’une kinase avec un inhibiteur entraîne parfois une suractivation d’autres kinases, ce qui peut expliquer comment les cellules cancéreuses s’adaptent et continuent de croître. Et cela peut aider les chercheurs à développer des thérapies plus efficaces, a déclaré Turk.
À l'avenir, Turk vise à utiliser les règles découvertes dans ce travail pour commencer à distinguer les processus biologiques clés et à approfondir la façon dont différentes cellules réagissent à divers inhibiteurs de kinases.
Mais il y a un autre point clé à retenir de ce travail pour lui.
Les tyrosine kinases sont plus récentes, sur le plan évolutif, que les autres kinases, émergeant avec les organismes multicellulaires. Lorsque Turk et ses collègues ont comparé les tyrosine kinases humaines à celles des nématodes (un type de ver dont la branche humaine de l'arbre évolutif a divergé il y a des millions d'années), la spécificité des deux groupes de kinases, ou leur degré de précision quant à leurs cibles, a montré étaient extrêmement similaires.
"Cela signifie que cette spécificité – et comprendre comment elle se produit – compte vraiment", a déclaré Turk. "Il a été conservé tout au long de millions d'années d'évolution, et la nature ne l'aurait pas conservé avec autant de détails sans raison."
Plus d'informations : Lewis Cantley, La spécificité intrinsèque du substrat du kinome de la tyrosine humaine, Nature (2024). DOI : 10.1038/s41586-024-07407-y. www.nature.com/articles/s41586-024-07407-y
Informations sur le journal : Nature
Fourni par l'Université de Yale