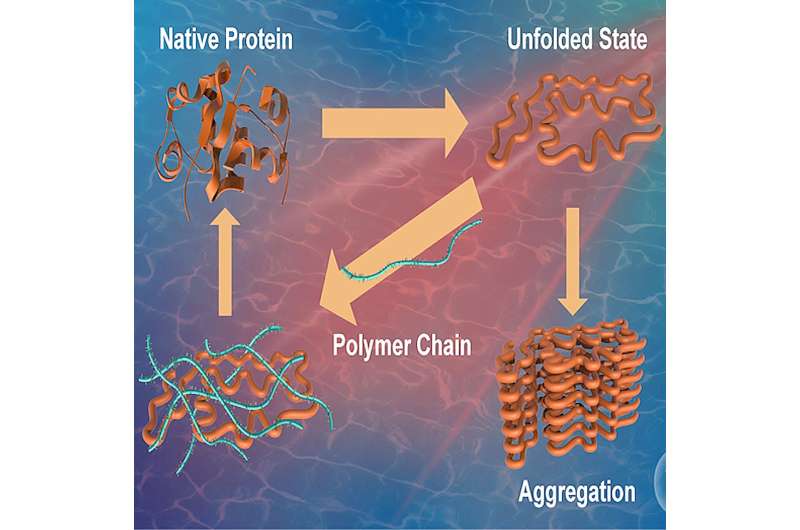
Les protéines sont des biomolécules vitales responsables de l’exécution de diverses fonctions dans le corps humain et sont donc considérées comme les bêtes de somme d’une cellule. La structure primaire d’une protéine est composée de différents acides aminés réunis. La structure ainsi formée subit ensuite un repliement protéique, un processus par lequel une protéine acquiert sa configuration tridimensionnelle caractéristique et fonctionnelle.
Cet état, appelé « état natif », est crucial pour le bon fonctionnement des protéines. Des conditions défavorables, telles que le stress ou l'exposition à des agents externes, peuvent provoquer un mauvais repliement des protéines et la formation d'agrégats, entravant leur capacité à remplir leurs fonctions d'origine.
Le mauvais repliement des protéines a été impliqué comme la cause sous-jacente d'une série de maladies humaines, notamment la maladie d'Alzheimer, la maladie de Huntington et la maladie de Parkinson. De plus, on sait également que la formation d’agrégats a un impact sur l’efficacité et la sécurité des médicaments à base de protéines. Cela souligne la nécessité d'étudier des composés et des stratégies capables de supprimer les erreurs de repliement et d'améliorer la stabilisation des protéines.
Des études récentes ont rapporté la capacité de stabilisation des protéines de quelques polymères. Cependant, leur mécanisme d'action et l'impact des interactions entre les composants hydrophobes (les composants qui repoussent l'eau) et les protéines ne sont pas bien compris.
Pour combler ce manque de connaissances, une équipe de chercheurs dirigée par le professeur Kazuaki Matsumura du Japan Advanced Institute of Science and Technology (JAIST), comprenant l'ancien professeur adjoint Robin Rajan, le doctorant Dr Dandan Zhao du JAIST et le professeur adjoint Tadaomi Furuta de l'Institut de technologie de Tokyo, a mené une étude pour élucider le mécanisme d'inhibition de l'agrégation des protéines par la sulfobétaïne (SPB).
Dans leur étude publiée dans Cell Reports Physical Science , les chercheurs ont également tenté de comprendre les interactions spécifiques qui se produisent entre les composants hydrophobes et les protéines et leur impact sur l'agrégation des protéines.

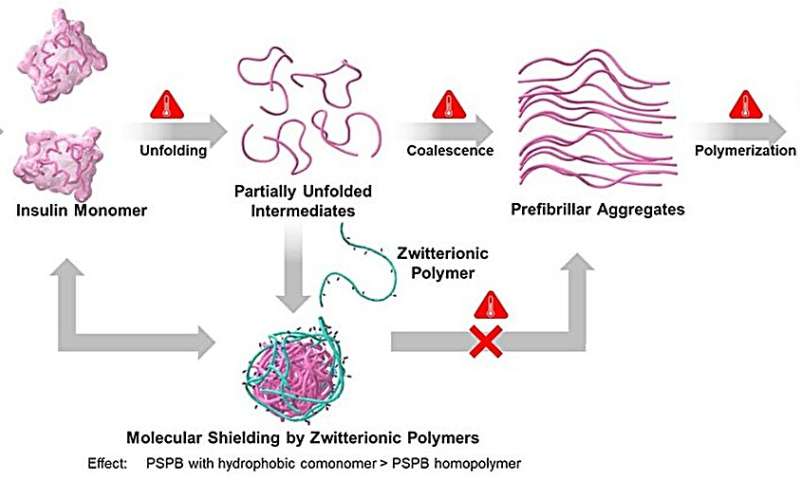
Expliquant la raison d'être de cette étude, le professeur Matsumura déclare :« Auparavant, nous avons mené une étude sur les polysulfobétaïnes (PSPB), un polymère zwitterionique constitué de groupes fonctionnels portant à la fois des charges positives et négatives. Nous avons constaté que le polymère présentait une efficacité exceptionnelle dans la suppression. l'agrégation des protéines. Cependant, l'impact de l'hydrophobicité est resté inexploré."
Dans cette étude, les chercheurs ont synthétisé des PSPB avec différents poids moléculaires et ont ajouté des quantités variables de monomères hydrophobes individuellement et avec différentes chaînes alkyle grâce à un processus connu sous le nom de polymérisation par transfert de chaîne par addition-fragmentation réversible. Les chercheurs ont ensuite analysé les propriétés stabilisatrices des protéines de ces polymères et examiné les interactions entre polymères et protéines grâce à des techniques physico-chimiques.
Leurs résultats ont révélé que les PSPB offraient une stabilisation des protéines en perturbant les voies importantes impliquées dans l'agrégation des protéines. De plus, l’hydrophobie et le poids moléculaire ont tous deux une influence sur la prévention de l’agrégation des protéines et sur l’amélioration de la stabilisation des protéines. L'augmentation de ces facteurs a amplifié les interactions faibles et réversibles entre le SPB et les protéines.
"Nous pouvons considérer ces polymères comme des boucliers moléculaires réversibles, qui perturbent la voie d'agrégation", explique le professeur Matsumura, tout en discutant des résultats de leur étude. Les chercheurs ont également découvert qu'après l'élimination du stress, un repliement des intermédiaires partiellement dépliés était observé, suggérant un retour à leur état d'origine.
Ainsi, en démêlant les mécanismes moléculaires complexes de la suppression de l'agrégation des protéines par les polymères zwitterioniques, cette étude pionnière pourrait ouvrir la voie à de nouvelles stratégies thérapeutiques qui retardent ou préviennent les maladies et contribuent à garantir la sécurité des médicaments à base de protéines.
Selon les mots du professeur Matsumura :« D'ici 5 à 10 ans, cette recherche pourrait conduire au développement de nouveaux traitements plus efficaces pour les affections liées au mauvais repliement des protéines, améliorant ainsi considérablement les résultats pour les patients. et des thérapies protéiques rentables, bénéficiant à l'industrie pharmaceutique et aux prestataires de soins de santé. "
Plus d'informations : Mécanisme moléculaire de l'inhibition de l'agrégation des protéines avec les polymères de sulfobétaïne et leurs dérivés hydrophobes, Cell Reports Physical Science (2024). DOI :10.1016/j.xcrp.2024.102012. www.cell.com/cell-reports-phys … 2666-3864(24)00280-7
Informations sur le journal : Rapports cellulaires sur la science physique
Fourni par l'Institut avancé des sciences et technologies du Japon