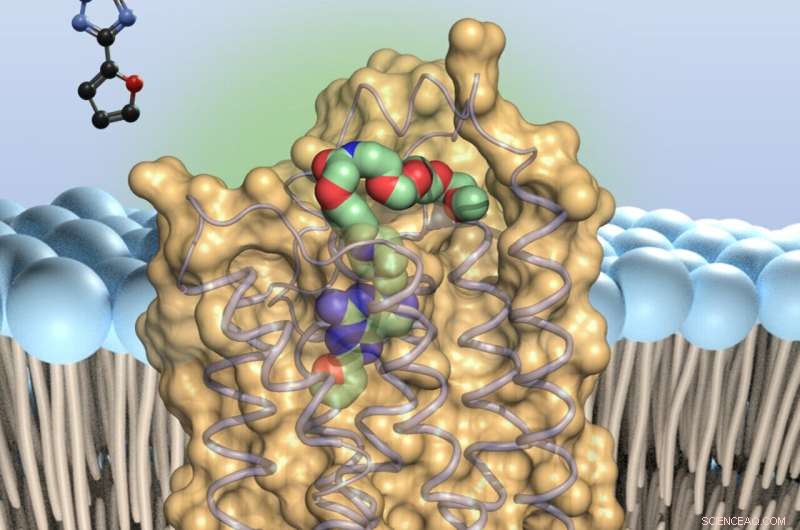
L'antagoniste de l'adénosine (coloré) - se lie à de minuscules antennes à la surface des cellules immunitaires, les récepteurs de l'adénosine de type 2A. Cela ralentit les troupes immunitaires. Crédit :Université de Bonn
Le récepteur A2A régule la vigueur avec laquelle le système immunitaire inné attaque les cellules malades. Des chercheurs de l'Université de Bonn ont pu montrer pour la première fois comment un inhibiteur important se lie au récepteur. À l'avenir, les résultats faciliteront la recherche ciblée de molécules qui donneront plus de punch au système immunitaire inné. Ceux-ci pourraient par exemple être utilisés dans la lutte contre le cancer, mais aussi contre les maladies du cerveau telles que la maladie d'Alzheimer ou la maladie de Parkinson. La version finale de l'étude a été publiée dans la revue Angewandte Chemie International Edition .
Quiconque aime lire des thrillers le sait :avant que les voleurs ne pénètrent dans un manoir, ils aiment lancer une côtelette juteuse par-dessus la clôture, dans laquelle ils ont caché quelques somnifères. Lorsque les chiens de garde se mettent à leur deuxième dîner, ils succombent à un profond sommeil peu de temps après. Les bijoux de la maîtresse de maison changent de mains beaucoup plus imperturbables par la suite.
Les cellules tumorales procèdent souvent d'une manière très similaire :elles rejettent les somnifères qui paralysent le système immunitaire. Plus précisément, ils s'entourent d'un nuage d'adénosine, important messager endogène. De cette façon, ils désactivent les propres "cellules tueuses" du corps, qui entraîneraient autrement la mort des cellules cancéreuses.
En effet, les molécules d'adénosine se lient à de minuscules antennes à la surface des cellules immunitaires, les récepteurs A2A (l'abréviation signifie "récepteurs d'adénosine de type 2A"). Cela assomme les troupes défensives, pour ainsi dire. Les chercheurs du monde entier recherchent donc des molécules capables de bloquer le récepteur A2A et d'empêcher l'effet paralysant de l'adénosine.
Bombardement aux rayons X
"Notre étude devrait rendre cette recherche beaucoup plus facile", explique le professeur Dr Christa Müller de l'Institut pharmaceutique de l'Université de Bonn. "Nous avons ajouté de nouvelles variantes d'un inhibiteur connu, une substance appelée préladenant, au récepteur A2A. Ensuite, nous avons créé des cristaux à partir des complexes récepteur-inhibiteur - c'est la première fois au monde que cela a été réalisé avec des substances de type préladenant. "
La cristallisation a permis d'élucider la structure du complexe. "Pour ce faire, nous bombardons le complexe de rayons X", explique Tobias Claff, qui a réalisé l'essentiel des expériences. "Le cristal diffracte les rayons. La façon dont il le fait nous permet ensuite de déduire la structure spatiale du complexe, jusqu'à l'arrangement des atomes individuels et leurs interactions."
De cette façon, les chercheurs ont pu montrer à quels points du prélagnant du récepteur A2A se lie. Fort de ces connaissances, il est désormais possible de modifier spécifiquement l'inhibiteur pour lui conférer de meilleures propriétés. En plus d'avoir l'effet le plus fort possible, les médicaments ne doivent par exemple pas être décomposés trop rapidement. Ils doivent également pouvoir atteindre l'endroit où ils sont censés faire leur travail, en l'occurrence le cerveau. "Notre étude facilitera grandement l'optimisation de la substance", déclare Claff avec optimisme.
A2A appartient à un groupe de récepteurs qui régulent les fonctions clés du corps. Ils traversent la membrane des cellules. La partie d'entre eux qui se trouve à l'extérieur de la membrane sert de capteur, recevant des signaux moléculaires comme une antenne. Lorsqu'il le fait, il déclenche des réactions spécifiques avec sa partie qui dépasse dans la cellule. Cela active alors certains gènes, par exemple.
Colorant lié à la molécule inhibitrice
"Ces récepteurs sont extrêmement importants en raison de leur position centrale", explique Christa Müller, qui est également membre des domaines de recherche transdisciplinaire (TRA) "Building Blocks of Matter" et "Life and Health". "Beaucoup d'entre eux, cependant, sont malheureusement relativement instables. Ceci est défavorable pour les analyses structurales aux rayons X - la cristallisation prend des jours, parfois même des semaines." Les chercheurs ont donc spécifiquement modifié le récepteur A2A en un seul point, le rendant considérablement plus stable.
Additionally, they succeeded in attaching a dye to the preladenant with a kind of molecular string. "This allows us to control where in the tissue preladenant attaches to the A2A receptor," Müller says. At the same time, the length and flexibility of the nanostring ensures that the inhibitor is not obstructed from binding to the receptor.
Both advances could also serve as models for work with other receptors that belong to the same group. "The methods we have developed in Bonn in recent years will allow us to elucidate the structure of such and other cell membrane proteins in the future," the pharmacist is convinced. "There aren't many research facilities that can do this kind of structural analysis of extremely complex molecules." Activation of opioid receptor uncovered