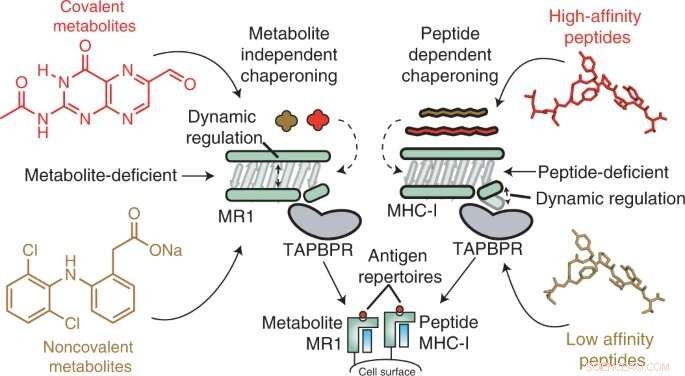
Résumé graphique. Crédit :Nature Chimie Biologie (2022). DOI :10.1038/s41589-022-01049-9
Dans une nouvelle étude publiée dans Nature Chemical Biology , des chercheurs de l'hôpital pour enfants de Philadelphie (CHOP) ont révélé la mécanique moléculaire d'une molécule de surface cellulaire qui est une cible potentielle d'immunothérapie. À l'aide de techniques sophistiquées, notamment la spectroscopie par résonance magnétique nucléaire (RMN), les chercheurs ont démontré l'importance des molécules dites chaperonnes dans la stabilisation de cette cible, connue sous le nom de protéine 1 liée au MHC-I (MR1).
Les molécules du complexe majeur d'histocompatibilité de classe I (MHC-I) vivent à la surface de presque toutes les cellules et présentent des antigènes peptidiques au système immunitaire, de sorte que les cellules immunitaires peuvent détecter la présence d'un antigène étranger, comme ceux des bactéries, des virus ou même développer des tumeurs. Dans un processus similaire, la protéine 1 liée au CMH-I (MR1) présente des métabolites plus petits à sa surface pour la surveillance par des cellules immunitaires spécifiques de MR1, à savoir les cellules T invariantes associées aux muqueuses (MAIT).
MR1 est connu pour être important pour la reconnaissance des infections microbiennes, l'identification des cellules cancéreuses par opposition aux cellules saines et la régulation des maladies auto-immunes. Des études récentes suggèrent également que MR1 peut afficher une gamme beaucoup plus large de molécules, y compris des métabolites spécifiques au cancer, qui pourraient servir de capteurs internes pour la maladie. De plus, MR1 ne varie pas dans la population humaine, ce qui en fait une cible potentielle prometteuse pour l'immunothérapie. Cependant, avant cette étude, la mécanique moléculaire de MR1 était inconnue, en particulier le rôle des molécules chaperonnes dans la reconnaissance et la stabilisation des molécules MR1.
En utilisant des techniques in vitro et cellulaires, les chercheurs ont découvert que le MR1 fonctionne différemment du CMH-I, en particulier en ce qui concerne la charge moléculaire et l'affinité pour les chaperons moléculaires Tapasin et TAPBPR. Alors que MHC-1 a démontré une affinité élevée pour les chaperons moléculaires lorsqu'il est vide mais une faible affinité lorsqu'il est chargé d'antigènes de présentation, MR1 a interagi à des niveaux tout aussi faibles avec TAPBPR, qu'il soit chargé ou non de métabolites. Malgré la courte durée de vie du complexe, les chercheurs ont utilisé la RMN pour déterminer avec succès sa structure 3D dans un environnement aqueux physiologiquement pertinent. Fait intéressant, ces interactions de faible affinité permettaient toujours aux chaperons de catalyser le chargement et l'échange de molécules de métabolites directement sur la surface du MR1.
« Nos résultats fournissent une base pour l'utilisation de chaperons moléculaires pour stabiliser les molécules MR1 et pour permettre le chargement et la présentation des antigènes directement sur la surface cellulaire », a déclaré Nikolaos G. Sgourakis, Ph.D., professeur agrégé au Centre de médecine computationnelle et génomique. à l'hôpital pour enfants de Philadelphie et auteur principal de l'étude. « Les recherches futures devraient cribler les bibliothèques de métabolites pour voir lesquels présentent une forte affinité pour la liaison au MR1. Les chercheurs peuvent alors envisager des moyens d'augmenter l'expression de surface du MR1, potentiellement en favorisant des interactions MR1/chaperon plus stables via plusieurs approches, telles que l'utilisation de petites molécules. ." Une étude révèle la dynamique de protéines essentielles du système immunitaire