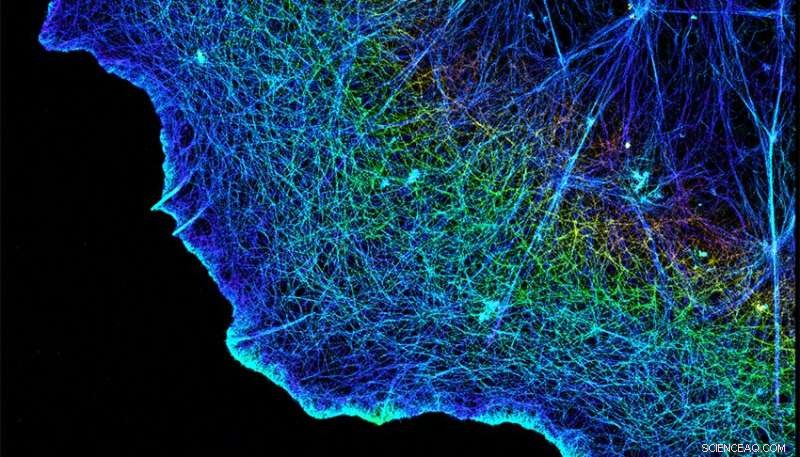
Les intégrines relient les cytosquelettes fibreux des cellules, illustrés ici, à la matrice qui les entoure. Crédit :Xiaowei Zhuang/HHMI/Université de Harvard/Nature Publishing Group
Nommez une fonction biologique, et des protéines appelées intégrines y sont probablement impliquées.
Ensemble, les 24 membres de la famille des intégrines permettent aux cellules de s'attacher les unes aux autres et à la matrice qui les entoure. Ils aident les cellules à décider quoi devenir, où aller, comment réagir à leur environnement et quand grandir, se diviser ou mourir.
L'omniprésence et la polyvalence des intégrines signifient également que lorsque les cellules qui les portent tournent mal, ces protéines peuvent contribuer à une gamme de maladies, des maladies auto-immunes au cancer.
La FDA a jusqu'à présent approuvé six médicaments qui réduisent l'activité d'intégrines spécifiques pour traiter des maladies telles que la sclérose en plaques et la colite ulcéreuse et pour empêcher la formation de caillots sanguins. À la déception des scientifiques, des médecins et des patients, cependant, d'autres candidats prometteurs ont échoué dans les essais cliniques et ont réduit le potentiel des intégrines en tant que cibles thérapeutiques.
De nouveaux travaux menés par des chercheurs de la Harvard Medical School et du Boston Children's Hospital révèlent la raison de ces échecs et proposent une solution potentielle.
Examinant de près une intégrine impliquée dans la coagulation du sang, Timothy Springer, professeur de chimie biologique et de pharmacologie moléculaire de la famille Latham au HMS et au Boston Children's, et ses collègues ont découvert que les médicaments ayant échoué pour deux intégrines différentes encourageaient par inadvertance les intégrines à s'ouvrir dans leur position "on", activant potentiellement l'activité des intégrines au lieu de la réprimer.
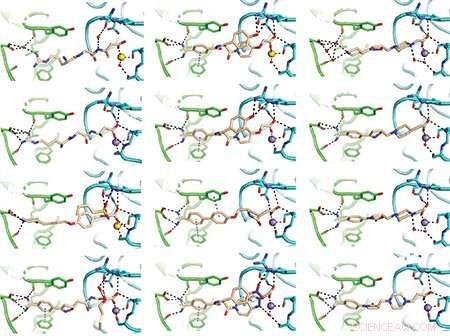
L'équipe a fait certaines de ses découvertes en utilisant la cristallographie aux rayons X, une méthode minutieuse pour déterminer les structures moléculaires des protéines. Voici quelques-uns des diagrammes résultants des médicaments liés à l'intégrine liée au caillot. Images :Fu-Yang Lin, Jing Li, Yonghua Xie, et al., Cellule
L'équipe a révélé que dans sa position fermée ou "off", l'intégrine contient une molécule d'eau maintenue en place par une série de liaisons chimiques. L'intégrine éjecte la molécule d'eau lorsqu'elle est activée.
Une fois qu'ils ont compris ce qui se passait, les chercheurs ont pu concevoir des bloqueurs d'intégrine qui ont amené la protéine de coagulation dans sa position "off" en maintenant la molécule d'eau en place avec un atome d'azote.
D'autres tests ont laissé entendre que les molécules d'eau jouent le même rôle dans d'autres intégrines, ce qui indique que la stratégie de l'équipe pourrait fonctionner plus largement.
Les résultats, publiés dans la revue Cell le 15 septembre, tracez une voie plus claire pour le développement de médicaments et approfondissez la compréhension des chercheurs sur le fonctionnement normal des intégrines.
"Le même principe de conception d'exploitation de l'eau a déjà été étendu à une autre intégrine, et des informations structurelles suggèrent que les chercheurs peuvent concevoir des médicaments pour cibler d'autres membres de la famille des intégrines afin de traiter des maladies qui causent de grandes souffrances", a déclaré Springer, membre de le programme de médecine cellulaire et moléculaire du Boston Children's.
"C'est toujours gratifiant de travailler sur un projet qui est à la fois scientifiquement et médicalement important", a-t-il ajouté. Les protéines gardent une emprise sur les cellules