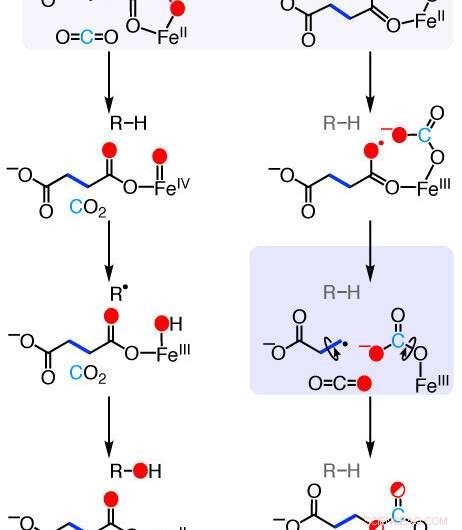
Mécanismes des réactions de l'enzyme formatrice d'éthylène (EFE). De nouvelles recherches décrivent les étapes chimiques utilisées par cette enzyme naturelle pour convertir un composé chimique courant en éthylène, une hormone végétale importante pour la maturation des fruits et un produit chimique industriel utilisé dans la production de plastiques et de textiles. Crédit :Rachelle Copeland, État de Pennsylvanie
De nouvelles recherches décrivent les étapes chimiques utilisées par une enzyme naturelle pour convertir un composé chimique courant en éthylène, une hormone végétale importante pour la maturation des fruits et un produit chimique industriel utilisé dans la production de plastiques et de textiles. Un article décrivant les recherches menées par des scientifiques de Penn State paraît en ligne le 12 août dans le journal Science .
« Parce que l'éthylène est si important dans l'industrie manufacturière pour la fabrication des plastiques, solvants et textiles, c'est l'un des composés les plus abondamment produits sur Terre, " dit Rachelle Copeland, un récent doctorat de Penn State et premier et co-auteur de l'article. "Actuellement, le pétrole est notre principale source d'éthylène pour ces utilisations. Cependant, les plantes et certains microbes produisent naturellement de l'éthylène. Comprendre le processus chimique étape par étape utilisé par ces plantes et ces microbes pourrait nous aider à nous éloigner de la production d'éthylène à base de pétrole. »
La bien nommée « enzyme formatrice d'éthylène (EFE) » est capable de transformer un composé chimique courant, le 2-oxoglutarate, qui se trouve dans presque tous les organismes où il joue un rôle dans le métabolisme - en éthylène, mais les chercheurs n'avaient pas pu caractériser avec précision le mécanisme employé par l'enzyme. La réaction requise pour cette transformation est fondamentalement différente des réactions entraînées par des enzymes étroitement liées à l'EFE.
Les enzymes sont des protéines qui initient ou accélèrent les réactions chimiques nécessaires au maintien de la vie, dont la plupart nécessitent des atomes, amas d'atomes, ou de petites molécules, collectivement appelées cofacteurs, pour que ces réactions se produisent. L'EFE appartient à une classe d'enzymes qui favorisent les réactions de divers types de molécules avec l'oxygène, activé par un cofacteur de fer et un co-substrat de 2-oxoglutarate.
"Notre groupe de laboratoire étudie les enzymes liées à l'EFE depuis près de 20 ans, " a déclaré Carsten Krebs, professeur de chimie et de biochimie et biologie moléculaire à Penn State et auteur de l'article. « L'EFE est unique dans cette famille d'enzymes car elle décompose le 2-oxoglutarate de deux manières différentes. La première est bien caractérisée, mais la seconde, celui qui produit de l'éthylène, a été un mystère jusqu'à maintenant."
L'équipe de recherche a disséqué la voie chimique de la formation d'éthylène par l'EFE en insérant des isotopes, des atomes qui diffèrent par leur poids atomique et peuvent être tracés au fur et à mesure que la réaction est en cours, dans les différents produits. De cette façon, l'équipe pourrait suivre des atomes individuels pour voir où ils vont au cours de la réaction. Séparément, ils ont également apporté des modifications chimiques à la fois à l'enzyme et au 2-oxoglutarate pour voir comment la réaction et les produits étaient modifiés.
« En utilisant ces techniques, nous avons pu voir que l'EFE initie la réaction entre le 2-oxoglutarate et l'oxygène d'une manière très différente des autres enzymes apparentées, " a déclaré Copeland. " Il insère l'oxygène entre deux atomes de carbone de 2-oxoglutarate, qui produit un composé intermédiaire unique que l'enzyme décompose ensuite en éthylène."
L'emplacement de l'atome d'oxygène inséré avait été prédit par ordinateur mais n'avait pas été montré expérimentalement jusqu'à présent.
"Il y a eu plusieurs mécanismes proposés au fil des ans pour expliquer comment l'EFE convertit le 2-oxoglutarate en éthylène, mais il n'y a pas eu de données expérimentales pour les distinguer, " a déclaré J. Martin Bollinger Jr., professeur de chimie et de biochimie et biologie moléculaire à Penn State et auteur de l'article. "Rachelle a conçu ces expériences pour examiner les aspects les plus fondamentaux de la réaction. Où vont les atomes individuels ? Et cela trace un mécanisme indubitablement clair."