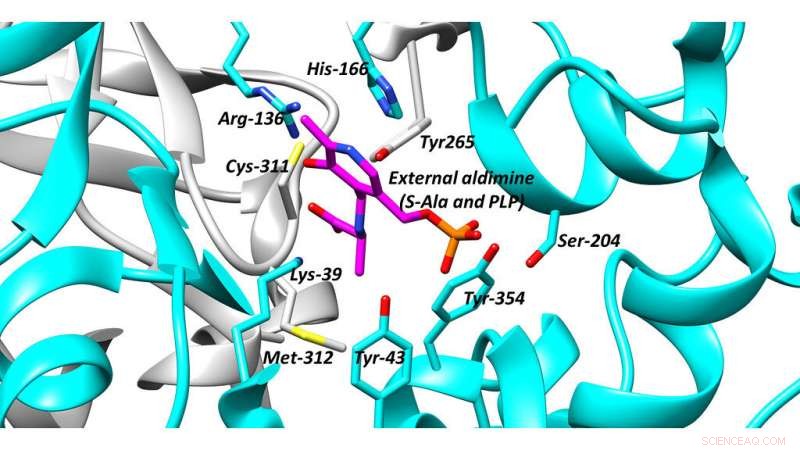
Le site actif de l'alanine racémase, une cible antibactérienne clé. Crédit :Université de Bath
Des scientifiques de l'Université de Bath au Royaume-Uni explorent les racémases, un type d'enzyme important qui est lié à certains cancers et à d'autres maladies potentiellement mortelles tout en étant également essentiels à la fonction cellulaire, dans un article publié dans la prestigieuse revue. Avis de la société chimique . Les scientifiques proposent également de nouvelles stratégies pour trouver des médicaments qui neutralisent ces enzymes.
De nombreuses racémases et épimérases jouent un rôle vital dans les cellules humaines et animales, et dans les organismes pathogènes. Ils facilitent le bon fonctionnement nerveux, la dégradation des substances toxiques, la formation de parois cellulaires bactériennes et la conversion de certains médicaments en leur forme active (la conversion la plus connue est observée avec l'ibuprofène, qui est pris comme un mélange d'isomères et converti dans le foie en l'isomère S actif). Mais alors que des niveaux normaux de fonction racémase et épimérase sont généralement bénéfiques, des niveaux accrus peuvent être nocifs. À cause de ce, il existe un intérêt considérable pour le développement de médicaments ayant un impact sur ces enzymes.
Il y a eu des résultats prometteurs dans les expériences de laboratoire où les racémases (et les épimérases apparentées) ont été ciblées avec des molécules médicamenteuses expérimentales. Ces molécules réduisent l'activité fonctionnelle des racémases et ont le potentiel d'être développées dans de nouveaux traitements pour un large éventail de maladies, y compris la prostate, cancers du sein et du cerveau; maladie d'Alzheimer et autres démences; infections bactériennes et virales; La maladie de Chagas, et les complications du diabète.
Les succès notables dans le développement de molécules combattant la racemase comprennent l'identification de la D-cyclosérine (un produit naturel découvert en 1954), qui est utilisé dans le traitement de la tuberculose, une menace majeure pour la santé mondiale.
Jusqu'à maintenant, il n'y a pas eu d'examen général de la façon dont les médicaments peuvent être utilisés pour empêcher ces enzymes puissantes de fonctionner. Le nouvel article de Bath explore toutes les stratégies connues utilisées pour concevoir ou découvrir de tels médicaments, y compris les méthodes adoptées pour mesurer la fonction de la racémase et, par extension, l'efficacité du médicament. L'article passe également en revue les avancées récentes dans le développement de médicaments ciblant des enzymes spécifiques, y compris l'alpha-méthylacyl-CoA racémase, une enzyme liée au cancer de la prostate, et qui fait l'objet des propres recherches de l'équipe.
En outre, les chercheurs de Bath ont entrepris de développer un modèle cohérent de la façon dont les racémases et les épimérases remplissent leurs fonctions. Leur espoir est d'utiliser ce modèle pour concevoir et développer des médicaments plus efficaces.
Ce qui rend les racémases et les épimérases spéciales, c'est leur capacité à modifier la chiralité des molécules, c'est-à-dire la façon dont les groupes dans les molécules se tordent. De nombreuses molécules biologiques présentent une chiralité, et la direction des torsions d'une molécule donnée détermine son fonctionnement :les molécules à image miroir ayant exactement la même structure peuvent se comporter très différemment dans les systèmes biologiques. Ce phénomène d'image miroir est connu sous le nom d'isomérie stéréochimique, et les molécules d'image miroir sont les isomères.
Dans les systèmes biologiques, l'un des deux isomères stéréochimiques prédomine, mais il existe de nombreux exemples où l'isomère moins abondant joue un rôle spécifique, rôle essentiel dans la cellule. Par exemple, l'acide aminé L-sérine est abondant dans les protéines et les membranes de toutes les cellules, tandis que son isomère D-sérine a un rôle spécialisé dans la neurotransmission chez l'homme et d'autres animaux supérieurs. Les racémases et les épimérases catalysent la formation du moins abondant des deux isomères du plus abondant, et donc changer la façon dont la molécule se tord. Ils effectuent leurs réactions en utilisant plusieurs stratégies chimiques différentes, mais de loin le plus courant est l'élimination d'un proton d'un atome de charbon actif suivie de la livraison d'un proton du côté opposé pour éteindre l'intermédiaire résultant.
En plus du rôle qu'ils jouent dans la santé humaine, les racémases et les épimérases ont d'importantes applications biotechnologiques dans les voies vertes et durables vers des produits chimiques à haute valeur économique. Ces enzymes peuvent être utilisées pour produire des isomères stéréochimiques difficiles d'accès d'acides aminés et d'autres molécules importantes dans l'alimentation, produits de beauté, industries pharmaceutiques et de chimie fine.
Pendant de nombreuses années, l'équipe de Bath a travaillé sur l'-méthylacyl-CoA racémase (AMACR), une enzyme suractivée dans le cancer de la prostate et d'autres cancers. Recherche sur cette enzyme, et sur la recherche de composés pour l'empêcher de fonctionner, a été financé par plusieurs organisations, y compris le cancer de la prostate au Royaume-Uni.
Dr Matthew Lloyd, auteur principal de l'article, a déclaré:"Les racémases et les épimérases ont traditionnellement été considérées comme des enzymes de niche, Cependant, leur position centrale dans les processus biologiques signifie qu'ils constituent d'excellentes cibles de médicaments et peuvent être exploités dans la fabrication de produits chimiques importants qui ont une grande valeur économique car ils sont utilisés dans l'alimentation, cosmétique, industries pharmaceutiques et autres.
"Notre analyse systématique des enzymes racémases, les réactions qu'ils catalysent et les manières dont ils peuvent être empêchés de fonctionner révèlent plusieurs thèmes communs et suggèrent plusieurs nouvelles pistes de recherche. Grâce à notre revue détaillée, nous avons maintenant une bien meilleure compréhension théorique du fonctionnement de ces enzymes, et cette connaissance est essentielle pour que ces enzymes soient efficacement ciblées par les nouveaux médicaments en cours de développement."
Il a ajouté :« Il est également clair qu'il existe plusieurs stratégies potentielles pour développer de nouveaux médicaments, tels que la conception de médicaments à base de fragments et le criblage virtuel, qui sont mûrs pour l'exploitation. Nous espérons que cet article stimulera de nouvelles recherches sur ces enzymes sous-estimées."
Simon Grieveson, responsable de la recherche chez Prostate Cancer UK, a déclaré :« Le cancer de la prostate est le cancer le plus fréquent chez les hommes, et nous avons désespérément besoin de meilleurs traitements. C'est pourquoi nous nous engageons à financer des recherches comme celle-ci, qui explorent de nouvelles façons prometteuses de lutter contre la maladie.
"Grâce à leur travail de laboratoire détaillé, Le Dr Lloyd et son équipe ont réussi à trouver des moyens de cibler et de supprimer une protéine clé impliquée dans la croissance du cancer de la prostate. Nous sommes impatients de voir comment cette recherche progressera dans les années à venir et son rôle dans le développement de nouveaux traitements pour les hommes."